
分析 (1)根据氧化剂氧化性大于氧化产物的氧化性,还原剂还原性大于还原产物的还原性判断;
(2)IO3-+I-+H+=I2+H2O反应中IO3-的I元素化合价由+5降低到0价,I-的I元素化合价由-1升高到0价,根据得失电子及电荷守恒配平;
(3)还原性HSO-3>I-,首先发生反应:2IO3-+6HSO3-═2I-+6SO42-+6H+,HSO3-反应完毕,继续加入KIO3,由于氧化性IO-3>I2,再发生反应:IO3-+6H++5I-=3H2O+3I2.
解答 解:(1)5HSO3-+2IO3-=5SO42-+I2+3H++H2O①,反应中氧化剂IO3-的氧化性大于氧化产物SO42-,还原剂的还原性HSO3-大于还原产物I2,
H2O+HSO3-+I2=SO42-+2I-+3H+②氧化剂的氧化性I2大于SO42-,还原剂的还原性HSO3-大于还原产物I-,
IO3-+I-+H+=I2+H2O(未配平)③反应中氧化剂IO3-的氧化性大于氧化产物I2,还原剂I-的还原性大于I2,
上述反应中氧化剂由强到弱的顺序为:IO3->I2>SO42-,还原剂由强到弱的顺序为:HSO3->I2>I-,
故答案为:IO3->I2>SO42-;HSO3->I2>I-;
(2)IO3-+I-+H+=I2+H2O反应中IO3-的I元素化合价由+5降低到0价,电子转移5e-,I-的I元素化合价由-1升高到0价,电子转移e-,结合电子守恒得到反应③配平的离子方程式为:IO3-+5I-+6H+=3I2+3H2O,
故答案为:IO3-+5I-+6H+=3I2+3H2O;
(3)在含3molNaHSO3的溶液中逐滴加入含1molKIO3的溶液,反应完全后,还原性HSO-3>I-,首先发生反应:2IO3-+6HSO3-═2I-+6SO42-+6H+,HSO3-反应完毕,混合溶液中所含的阴离子有I-、SO42-,碘元素化合价+5价变化为-1价,则电子转移12e-,物质的量为 12mol,若要使溶液中的n(I2)最大,
2IO3-+6HSO3-═2I-+6SO42-+6H+,
1mol 3mol 1mol
IO3-+6H++5I-=3H2O+3I2;
1 5
0.2mol 1mol
则需滴加n(IO3-)对应的最小值为1.2mol,
故答案为:I-、SO42-;12mol;1.2mol.
点评 本题考查了氧化还原反应,主要是氧化还原反应强弱比较,离子方程式书写、氧化还原反应定量关系的计算等,掌握基础是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.01 mol•L-1HA的溶液中 c(H+)=l×l0-4mol•L-1 | |
| B. | pH=3的HA溶液与pH=ll的NaOH溶液等体积混合后所得溶液中:c(Na+)=c(A-)>c(OH-)=c(H+) | |
| C. | 浓度均为0.1 mol•L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则c(H+)-c(OH-)>c(A-)-c(HA) | |
| D. | pH=3的HA溶液与pH=11的NaOH溶液混合后所得溶液显碱性,则 c(Na+)>c(A-)>c(OH-)><c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
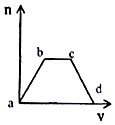 将足量CO2通入KOH和Ca(OH)2的混合溶液中,生成沉淀的质量(m)和通入CO2体积(V)的关系如图所示:
将足量CO2通入KOH和Ca(OH)2的混合溶液中,生成沉淀的质量(m)和通入CO2体积(V)的关系如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入AgNO3溶液,可生成白色沉淀,加稀盐酸沉淀不消失,则可确定该溶液中一定含有Cl-, | |
| B. | 用试管加热碳酸氢钠固体时试管口竖直向上 | |
| C. | 实验室需要800mL0.1mol•L-1NaOH溶液,需要称取4.0gNaOH进行配制 | |
| D. | 实验室中可用碱石灰干燥氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
| 编号 | 实验操作 | 预期现象和结论 |
| ① | 在试管中加入少量FeCl3溶液和过量 (填少量、过量)的KI溶液. | 深红色如期出现 |
| ② | 将试管中的混合溶液转移至分液漏斗 (填仪器)中,倒入一定量的CCl4, 塞住活塞,充分振荡(萃取),静置. | 液体分层,上层接近无色,下层紫红色 |
| ③ | 打开活塞,先放出下层液体,再从分液漏斗的上口中倒出水层于试管中,加入KSCN溶液 | 出现血红色,则反应后的混合物中含Fe3+,进而证明这的确是一个可逆反应;反之则不含Fe3+,进而证明不是一个可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

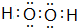 ,化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-
,化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的离子方程式为Na2O2+2H2O+S2-=S+4Na++4OH-查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com