
| A. | O2 | B. | Fe | C. | H2 | D. | Hg |
科目:高中化学 来源: 题型:选择题
| A. | 用溴水检验CH2═CH-CHO中是否含有碳碳双键 | |
| B. | 1mol HCHO发生银镜反应最多生成4mol Ag | |
| C. | 乙醛能使高锰酸钾酸性溶液褪色 | |
| D. | 能发生银镜反应的有机物不一定是醛类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4的酸性比HClO的酸性强,所以S的非金属性比Cl强 | |
| B. | Mg(OH)2是中强碱,Al(OH)3是两性氢氧化物,所以Al比Mg活泼 | |
| C. | H2S 300℃时开始分解,H2O 1000℃时开始分解,说明O的非金属性比S强 | |
| D. | Na和Mg与酸都能激烈反应放出氢气,故无法比较它们的金属性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | 元素Z、W的简单离子的电子层结构不同 | |
| C. | 元素Y的简单气态氢化物的热稳定性比Z的强 | |
| D. | 只含X、Y、Z三种元素的化合物,可能是酸,也可能是盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都有酸性,电离出的H+有弱氧化性 | |
| B. | 它们都是酸,彼此之间不发生反应 | |
| C. | 亚硫酸易分解放出SO2,所以它是挥发性酸 | |
| D. | 在空气中放置,它们都会因氧化而变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
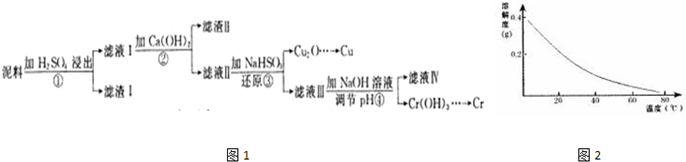 已知:部分物质沉淀的pH如表:
已知:部分物质沉淀的pH如表:| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 蘸有浓氨水的玻璃棒靠近某溶液 | 有白烟产生 | 该溶液可能是浓盐酸 |
| B | 将SO2通入Ba(NO3)2溶液 | 产生白色沉淀 | SO2与可溶性钡盐均可生成白色沉淀 |
| C | 将湿润淀粉碘化钾试纸检验某溶液 | 试纸变蓝 | 该溶液一定是氯水 |
| D | 用铂丝蘸取少量某溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 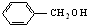 和 和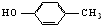 | B. | 乙酸和硬脂酸 | ||
| C. | 苯甲酸和  | D. | 硝基乙烷(CH3CH2NO2)和氨基乙酸5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com