
【题目】铁制自来水管与下列材料作成的自来水龙头连接,自来水管锈蚀最快的是
A.铁水龙头 B.铜水龙头 C.塑料水龙头 D.陶瓷水龙头
科目:高中化学 来源: 题型:
【题目】在酸性溶液中,下列能大量共存的离子组是
A. S2O32-、Na+、Cl-、K+ B. Na+、Mg2+、Cl-、SO42-
C. Ba2+、Na+、SO42-、OH- D. K+、H2H5OH、MnO4-、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应2SO2 + O2![]() 2SO3,已知反应过程中某一时刻SO2、 O2、SO3的浓度分别为2 mol·L-1 、1mol·L-1 、2mol·L-1。当反应达到平衡时,容器内各物质的浓度可能为
2SO3,已知反应过程中某一时刻SO2、 O2、SO3的浓度分别为2 mol·L-1 、1mol·L-1 、2mol·L-1。当反应达到平衡时,容器内各物质的浓度可能为
A. SO2为4 mol·L-1、 O2为2 mol·L-1 B. SO3为4 mol·L-1
C. SO2为2.5 mol·L-1 D. SO2 、SO3为1.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宋代著名法医学家宋慈的《洗冤集录》中有一“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2 =2Ag2S+2H2O。该反应中H2S是
A. 氧化剂
B. 还原剂
C. 既是氧化剂又是还原剂
D. 既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将 2 mol SO2 和 1 mol O2 充入一定容密闭容器中,在催化剂存在下进行下列反应: 2SO2(g)+ O2(g)![]() 2SO3(g);△H= -197 kJ/ mol,下列说法中正确的是
2SO3(g);△H= -197 kJ/ mol,下列说法中正确的是
A. 达到反应限度时,生成 SO3 为2 mol
B. 达到反应限度时,反应放出 197 kJ 的热量
C. 达到反应限度时SO2、O2、SO3的分子数之比一定为2∶1∶2
D. 达到反应限度时SO2的消耗速率必定等于SO3的消耗速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用序号填写下列空格:
(1)下列各组物质
①O2和O3 ②H2、D2和T2 ③12C和14 C ④石墨和足球烯(C60)
⑤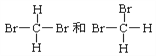 ⑥
⑥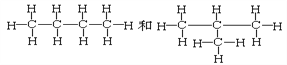
⑦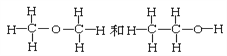 ⑧CH3CH3和CH3CH2CH2CH3
⑧CH3CH3和CH3CH2CH2CH3
互为同素异形体的是_____________;互为同位素的是______________,互为同分异构体的是______________,互为同系物的是_______________,同一种物质的是______________。
(2)现有① 金刚石 ② 干冰 ③ Na2SO4 ④ NH4Cl 四种物质,按下列要求回答:
晶体熔化时需要破坏共价键的是____________;熔点最低的是__________________;
晶体中只存在一种微粒间作用力是______________;属于离子晶体的是_____________。
请写出④ NH4Cl的电子式___________________
试判断 ①金刚石②干冰 ③Na2SO4晶体的熔点由高到低排列的顺序_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:
CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1
COS(g)+H2(g) K=0.1
反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,
总反应为:2CH3CHO+H2O![]() CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示。

(1)若以甲烷燃料电池为直流电源,则燃料电池中b极应通入 (填化学式)气体。
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。电极反应如下:
阳极:① 4OH--4e-=O2↑+2H2O② 。
阴极:① 。②CH3CHO+2e-+2H2O=CH3CH2OH+2OH-
(3)电解过程中,阴极区Na2SO4的物质的量 (填“增大”、“减小”或“不变”)。
(4)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同。下列关于阳极区溶液中各微粒浓度关系的说法正确的是 (填字母序号)。
a.c(Na+)不一定是c(SO42-)的2倍
b.c(Na+)=2c(CH3COOH)+2c(CH3COO-)
c.c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)
d.c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-)
(5)高纯度氧化铝是用于制备隔膜的材料,某研究小组用以下流程制取高纯度氧化铝:

①“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式 。
②配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 。
③“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com