
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c/(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
分析 (1)较低价态为亚,NaClO2的化学名称为亚氯酸钠;
(2)①亚氯酸钠具有氧化性,则NaClO2溶液脱硝过程中主要反应的离子方程式为3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O;正反应是体积减小的,则增加压强,NO的转化率提高;
②根据反应的方程式3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O可知随着吸收反应的进行氢氧根离子被消耗,吸收剂溶液的pH逐渐降低;
③由实验结果可知,在相同时间内硫酸根离子的浓度增加的多,因此脱硫反应速率大于脱硝反应速率.原因是除了SO2和NO在烟气中的初始浓度不同,还可能是二氧化硫的还原性强,易被氧化.
解答 解:(1)氯+7为高、+3为亚,NaClO2中氯的化合价为+3价,化学名称为亚氯酸钠,
故答案为:亚氯酸钠;
(2)①亚氯酸钠具有氧化性,且NaClO2溶液呈碱性,则NaClO2溶液脱硝过程中主要反应的离子方程式为3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O;正反应是体积减小的,则增加压强,NO的转化率提高,
故答案为:3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O;提高;
②根据反应的方程式3ClO2-+4NO+4OH-=4NO3-+3Cl-+2H2O可知随着吸收反应的进行氢氧根离子被消耗,吸收剂溶液的pH逐渐降低,
故答案为:减小;
③由实验结果可知,在相同时间内硫酸根离子的浓度增加的多,因此脱硫反应速率大于脱硝反应速率.原因是除了SO2和NO在烟气中的初始浓度不同,还可能是NO溶解度较低或脱硝反应活化能较高,
故答案为:大于;NO溶解度较低或脱硝反应活化能较高.
点评 本题考查化学式名称、离子方程式书写、外界条件对反应速率和平衡状态的影响等,要求学生掌握化学用语规范,结合生活实际分析问题、解决问题,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=+890.3 kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(l);△H=-890.3 kJ•mol-1 | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-890.3 kJ | |
| D. | 2H2(g)+O2(g)═2H2O(l);△H=-285.8 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 编号 | T/K | 催化剂的 用量/g | KMnO4酸性溶液 的浓度/mol?L-1 | 实验目的 |
| ① | 298 | 0.5 | 0.01 | (Ⅰ)实验①和②探究KMnO4酸性溶液的浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探究催化剂对该反应速率的影响 |
| ② | ||||
| ③ | ||||
| ④ |
| KMnO4酸性溶液的浓度/mol.L-1 | 溶液褪色所需时间t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 11 |
| 0.001 | 6 | 7 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气质量等级为优 | |
| B. | 二氧化硫的污染指数可能为42 | |
| C. | 目前,我国大部分地区空气中二氧化硫、二氧化氮及可吸入颗粒物等物质的含量偏高 | |
| D. | 对煤、石油等燃料进行脱硫处理、使用氢气等清洁燃料、通过静电沉降器除去悬浮颗粒物都可以治理大气污染,改善空气质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O含有3NA个原子 | |
| B. | 1 mol甲苯含有6NA个C-H键 | |
| C. | 标准状况下,22.4 L氯水含有NA个Cl2分子 | |
| D. | 2.8 g乙烯和丁烯的混合气体中所含原子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
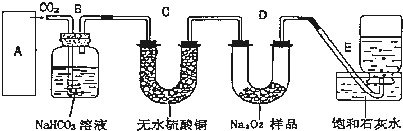
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com