
| 加热次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | c | d | e | e |
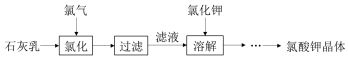
分析 (1)工业用电解饱和食盐水的方法生产氯气;
(2)温度升高有利于加快反应速率;
(3)热的氯酸钙与氯化钾反应生成溶解度更小的氯酸钾,用重结晶的方法可提纯氯酸钾晶体;
(4)①灼烧固体在坩埚中进行;
②第三次和第四次的固体质量恒重,说明分解完全;
③若某次测定结果的相对误差为-2.98%,说明所得数据偏小,可能为剩余固体质量偏大,据此分析.
解答 解:(1)工业用电解饱和食盐水的方法生产氯气,
故答案为:电解饱和食盐水;
(2)为加快反应速率,减少 Cl2与 Ca(OH)2之间发生副反应生产次氯酸钙,氯化过程升高温度;
故答案为:加快反应速率;
(3)热的氯酸钙与氯化钾反应生成溶解度更小的氯酸钾,反应为:Ca(ClO3)2+2KCl=CaCl2+2KClO3↓;用重结晶的方法可提纯氯酸钾晶体;
故答案为:Ca(ClO3)2+2KCl=CaCl2+2KClO3↓;重结晶;
(4)①灼烧固体在坩埚中进行;
故答案为:坩埚;
②由表中数据可知,第三次和第四次的剩余固体质量已恒重,说明 KClO3已分解完全,无需做第五次加热;
故答案为:剩余固体质量已恒重,说明 KClO3已分解完全;
③若某次测定结果的相对误差为-2.98%,说明所得数据偏小,可能为剩余固体质量偏大,可能为未在干燥器中冷却,剩余固体吸水(加热时间不足,氯酸钾未完全分解);
故答案为:未在干燥器中冷却,剩余固体吸水(加热时间不足,氯酸钾未完全分解).
点评 本题以物质制备为载体,考查学生对原理的分析理解、物质的分离提纯、氧化还原反应、物质含量测定实验方案设计、信息获取与迁移运用等,需要学生具备扎实的基础,题目难度中等.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1,则C(碳)的燃烧热为-110.5 kJ•mol-1 | |
| B. | 在101KPa下氢气的燃烧热△H=-285.5 kJ•mol-1,则水分解的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+285.5 kJ•mol-1 | |
| C. | 已知中和热△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的稀溶液与含1 mol NaOH的稀溶液混合,放出的热量为57.3 kJ | |
| D. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出热量28.7 kJ,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④⑤ | B. | ②③④ | C. | ②④⑤ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物油久置会出现油脂的酸败现象,是因为油脂发生了水解 | |
| B. | 有机玻璃、合成橡胶、涤纶都是由加聚反应制得的 | |
| C. | 糖类、油脂、蛋白质的水解产物都是非电解质 | |
| D. | 将已成熟的水果放入未成熟的水果中并密封,可加速水果成熟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | 元素的性质或原子结构 |
| W | M层上的电子数为4 |
| X | 常温下,其单质为双原子分子,其氢化物的水溶液显碱性 |
| Y | L层电子数为次外层电子数的3倍 |
| Z | 元素最高正价是+7价 |
| A. | 原子半径:W>X>Y | |
| B. | 化合物WY2不溶于水 | |
| C. | 由X、Y和氢三种元素形成的所有化合物中只含共价键 | |
| D. | 最高价氧化物对应水化物的酸性:W<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人类目前所直接利用的能量全部是由化学反应产生的 | |
| B. | 化学反应不一定伴随着能量变化 | |
| C. | 化学变化中的能量变化主要是由化学键变化引起的 | |
| D. | 化学反应中能量变化的大小与反应物质量的多少无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验样品 | Na2CO3 | 氯水 | NaCl固体 | 乙醇 |
| 实验数据 | 5.26mL | pH=2.3 | 10.3g | 78.3℃(沸点) |
| 实验仪器 | 酸式滴定管 | 广泛pH试纸 | 托盘天平 | 体温计 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com