
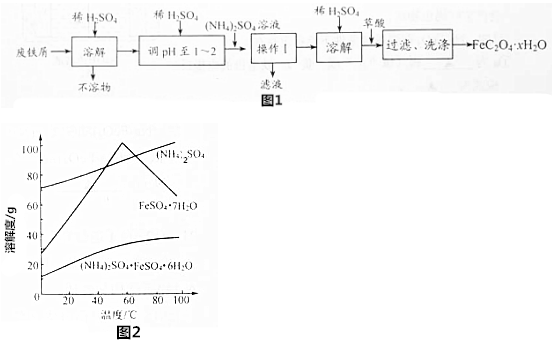
分析 废铁屑加入硫酸溶液溶解,加入硫酸铵溶液控制温度结晶析出(NH4)2SO4•FeSO4•6H2O晶体,加稀硫酸溶解,滴入几滴稀硫酸防止亚铁离子水解,加入草酸沉淀亚铁离子,过滤得到草酸亚铁晶体(FeC2O4•xH2O),
(1)①在5% Na2CO3溶液中加热数分钟,并洗涤干净是利用碳酸钠水解显碱性,去除油污;
②用稀硫酸调溶液pH至1~2的目的:一是抑制Fe2+和NH4+的水解;二是防止亚铁离子被氧化;
③由图2可知60℃左右时,(NH4)2SO4•FeSO4•6H2O溶解度较低,为得到(NH4)2SO4•FeSO4•6H2O,应控制温度60℃左右;
④FeC2O4•xH2O沉淀表面有硫酸根离子,检验最后一次洗涤液中是否含有硫酸根离子即可判断FeC2O4•xH2O沉淀是否洗净;
(2)MnO4-与Fe2+反应,高锰酸根离子将亚铁离子氧化为铁离子,本身被还原为锰离子,结合原子守恒可写;
(3)由硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)制备纯净FeSO4溶液,向一定量硫铁矿烧渣中加入足量的稀硫酸充分反应,过滤掉不溶解的SiO2,得到铁离子氯离子的溶液,向滤液中滴加过量的NaOH溶液,将铁离子沉淀为氢氧化铁,过滤洗涤沉淀,加稀硫酸溶解,加过量的铁粉,过滤即可.
解答 解:(1)①在5% Na2CO3溶液中加热数分钟,并洗涤干净是利用碳酸钠水解显碱性,油污会发生水解生成溶于水的物质洗去,作用是去除油污,
故答案为:除油污;
②用稀硫酸调溶液pH至1~2的目的:一是抑制Fe2+和NH4+的水解;二是防止亚铁离子被氧化,
故答案为:防止亚铁离子被氧化;
③由图2可知60℃左右时,(NH4)2SO4•FeSO4•6H2O溶解度较低,为得到(NH4)2SO4•FeSO4•6H2O,应控制温度60℃左右;
故答案为:60℃左右;
④FeC2O4•xH2O沉淀表面有硫酸根离子,取最后一次洗涤液,检查是否含有硫酸根离子进行设计分析,用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净;
故答案为:用小试管取少量最后一次洗涤液,加入BaCl2溶液,如出现白色沉淀,说明沉淀没有洗涤干净,否则,沉淀已洗涤干净;
(2)MnO4-与Fe2+反应的离子方程式为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(3)由硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)制备纯净FeSO4溶液,向一定量硫铁矿烧渣中加入足量的稀硫酸充分反应,过滤掉不溶解的SiO2,得到铁离子氯离子的溶液,向滤液中滴加过量的NaOH溶液,将铁离子沉淀为氢氧化铁,过滤洗涤沉淀,加稀硫酸溶解为硫酸铁溶液,加过量的铁粉,过滤即可得到硫酸亚铁溶液,故操作为:向一定量硫铁矿烧渣中加入足量的稀硫酸充分反应,过滤,向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体加入足量稀硫酸至固体完全溶解,再加入足量的铁粉,过滤,得到较纯净的FeSO4溶液;
故答案为:向滤液中滴加过量的NaOH溶液,过滤,充分洗涤固体,向固体加入足量稀硫酸至固体完全溶解,再加入足量的铁粉.
点评 本题考查了物质制备流程分析判断物质性质和试剂选择,沉淀生成、洗涤、检验等实验基本操作,侧重于实验控制和操作的考查,掌握基础是关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
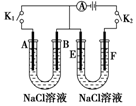 如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题.
如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)=c(SO42-)>c(Al3+) | |
| B. | x=15时,溶液中有NH4+、SO42-,且c(NH4+)<2c(SO42-) | |
| C. | x=20时,溶液中有NH4+、Al3+、OH-,且c(OH-)<c(Al3+) | |
| D. | x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-)=c(Ba2+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO、Al2O3熔点高,均可用作耐高温材料 | |
| B. | NH4HCO3受热易分解,可用作氮肥 | |
| C. | Fe2(SO4)3易溶于水,可用作净水剂 | |
| D. | SO2具有氧化性,可用于漂白纸浆 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3支 | B. | 2支 | C. | 1支 | D. | 0支 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙醛 | B. | 丁醇 | C. | 葡萄糖 | D. | 乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2C=CH2+HCl→H3C-CH2Cl | |
| B. | 2CH3CH2OH+O2$\stackrel{催化剂}{→}$2CH3CHO+2H2O | |
| C. | 2C6H6+15O2 $\stackrel{点燃}{→}$12CO2+6H2O | |
| D. | CH3CH3+Cl2→CH3CH2Cl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH溶液的导电能力比相同浓度的HCl溶液小 | |
| B. | 在25℃时,0.1mol/L的CH3COOH溶液pH约为3 | |
| C. | 在25℃时,1mol/L的CH3COONa溶液的pH约为9 | |
| D. | 0.1molCH3COOH和0.1 mol NaOH恰好中和生成CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | Si有导电性 | Si可用于制备光导纤维 |
| B | Fe的金属活动性大于Cu | FeCl3溶液可用于回收废旧电路板中的铜 |
| C | Na2O2与水反应能生成碱 | Na2O2属于碱性氧化物 |
| D | 次氯酸光照易分解 | 新制氯水保存在棕色试剂瓶中,放于冷暗处 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com