
【题目】能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应 CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
已知:①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;
②H2O (l) =H2O(g); △H=+dkJmol-1
则△H1= ___________(用含字母a、b、c、d的代数式表示)kJmol-1。
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g)![]() CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:

t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2_________ (填“>”“<”或“ = ”)0。
②下列说法正确的是____________ (填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③ 03 min内用CH3OH表示的反应速率v(CH3OH)=________mol L-1·min-1。
④ 200℃时,该反应的平衡常数K =_______。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡____________(填“正向”、“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为_________。
【答案】 -a+3b+c–d < cd ![]() (或0.067) 6.25 正向 60%
(或0.067) 6.25 正向 60%
【解析】(1) CH4(g)+H2O(g)=CO(g)+3H2(g)△H1,已知:①CH4、H2、CO 的燃烧热(△H)分别为-a kJmol-1、-b kJmol-1、-c kJmol-1;②H2O (l) =H2O(g); △H=+dkJmol-1,由盖斯定律可知,②×3+③-①-④可知,则△H1=-a+3b+c–d kJmol-1。
(2)CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示: ,①由图示可知在恒压条件下,随着温度的升高CO的转化率降低,说明升高温度平衡逆向移动,即正反应为放热反应,△H2<0。②a、正方向为放热反应,升高温度平衡逆向移动,平衡常数减小,故a错误;b.达平衡后再充入稀有气体,压强增大,但平衡不移动,CO的转化率不变,故b错误;c.CH4(g)+H2O(g)=CO(g)+3H2(g),达到平衡前气体总物质的量在不断变化,当容器内气体压强不再变化时,说明混合气体的总物质的量不再改变,反应达到平衡,即反应达到最大限度,故c正确;d.、由图示可知,在恒温恒容的条件下,增大压强,平衡向正方向移动,CO的转化率增大,即图中压强p1<p2,故d正确;故选cd;③由图表可知,3min后反应达到平衡状态
,①由图示可知在恒压条件下,随着温度的升高CO的转化率降低,说明升高温度平衡逆向移动,即正反应为放热反应,△H2<0。②a、正方向为放热反应,升高温度平衡逆向移动,平衡常数减小,故a错误;b.达平衡后再充入稀有气体,压强增大,但平衡不移动,CO的转化率不变,故b错误;c.CH4(g)+H2O(g)=CO(g)+3H2(g),达到平衡前气体总物质的量在不断变化,当容器内气体压强不再变化时,说明混合气体的总物质的量不再改变,反应达到平衡,即反应达到最大限度,故c正确;d.、由图示可知,在恒温恒容的条件下,增大压强,平衡向正方向移动,CO的转化率增大,即图中压强p1<p2,故d正确;故选cd;③由图表可知,3min后反应达到平衡状态
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始浓度(mol·L-1) 0.4 0.8 0
变化浓度(mol·L-1) 0.2 0.4 0.2
起始浓度(mol·L-1) 0.2 0.4 0.2
03 min内用CH3OH表示的反应速率v(CH3OH)=0.2mol·L-1/3min=1/15mol L-1·min-1。④ 200℃时,200℃时平衡常数K=c(CH3OH)/(c(CO)×c2(H2))=0.2/(0.2×0.42)=6.25;向上述200℃达到平衡的恒容密闭容器中再加入2mol CO、2mol H2、2mol CH3OH,此时各物质的浓度为c(CO)=0.4mol·L-1,c(H2)=0.6mol·L-1,c(CH3OH)=0.4mol·L-1,保持温度不变,则此时Qc=c(CH3OH)/[c(CO)×c2(H2)]=0.4/(0.4×0.62)=2.78<6.25=K,则此时平衡应向正方向移动;(3)甲烷、氧气和KOH溶液可组成燃料电池,CH4完全氧化后的产物为K2CO3,1mol甲烷完全燃烧转移电子的物质的量为[4-(-4)]mol=8mol。测得电路中转移1.2 mol电子,可知参加反应的甲烷为1.2mol/8mol ×1mol=0.15mol,标准状况下通入5.6 L甲烷的物质的量为5.6L/22.4L·mol-1=0.25mol,甲烷的利用率为0.15mol/0.25mol ×100%=60%。


科目:高中化学 来源: 题型:
【题目】如图所示装置可用来制取和观察Fe(OH)2在空气中被氧化的须色变化。实验时必须使用铁屑和6mol/L的硫酸,其他试剂任选。完成下列问题:
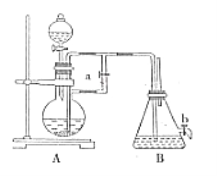
(1)B中盛有一定量的NaOH溶液,A中应预先加入的试剂是_______________,A中发生反应的目的是_____________________________。
(2)实验开始时应先将弹簧夹a________(填“打开”或“关闭”)。
(3)装置B中生成Fe(OH)2的操作及观察到的现象为_______________。
(4)实验完毕,打开b处弹簧夹,放入一部分空气,此时B中发生的反应为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3Cl2+6KOH![]() KClO3+5KCl+3H2O的反应中,下列说法不正确的是 ( )
KClO3+5KCl+3H2O的反应中,下列说法不正确的是 ( )
A. Cl2是氧化剂,KOH是还原剂
B. KCl是还原产物,KClO3是氧化产物
C. 反应中每消耗3 mol Cl2,转移电子数为5NA
D. 被还原的氯气的物质的量是被氧化的氯气的物质的量的5倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池可以使用在航天飞机上,其反应原理如图所示。下列有关氢氧燃料电池的说法中不正确的是
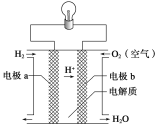
A. 该电池中电极a是正极
B. 外电路中电子由电极b通过导线流向电极a
C. 该电池的正极反应为O2+4H++4e- = 2H2O
D. 该电池的总反应:2H2+O2 = 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R为前四周期原子序数依次增大的元素。X原子有3个能级,且每个能级上的电子数相等;Z原子的不成对电子数在同周期中最多,且Z的气态氢化物在同主族元素的氢化物中沸点最低;X、Y、R三元素在周期表中同族。
(1)R元素基态原子的价层电子排布式为_____________________________。
(2)下图表示X、Y、Z的四级电离能变化趋势,其中表示Y的曲线是_________(填标号)。
[Failed to download image : http://192.168.0.10:8086/QBM/2018/6/1/1957930255540224/1961602752167936/STEM/676db9e64b15468faa67ccb9aa300976.png]
(3)化合物(XH2=X=O)分子中X原子杂化轨道类型分别是_____________,1mol (X2H5O)3Z=O分子中含有的σ键与π键的数目比为_______________。
(4)Z与氯气反应可生成一种各原子均满足8电子稳定结构的化合物,其分子的空间构型为________________。
(5)某R的氧化物立方晶胞结构如图所示,该物质的化学式为____________。(用元素符号表示),已知该晶体密度为ρg/cm3,距离最近的原子间距离为dpm,则R的相对原子质量为____________。(阿伏加德罗常数为NA)
[Failed to download image : http://192.168.0.10:8086/QBM/2018/6/1/1957930255540224/1961602752167936/STEM/02395761f35f4972ad3c8807ad342892.png]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学将反应2Fe3++2I-=2Fe2++I2设计成下图所示的原电池:

实验步骤及现象如下:
①闭合开关,指针发生偏转,随后电流计读数逐渐变小,当读数变为零时,打开开关;
②取少许甲烧杯中溶液,滴入3~4滴淀粉溶液,溶液显蓝色;
③取少许乙烧杯中溶液,滴入3~4滴KSCN溶液,溶液显血红色;
④向乙烧杯中加入少量FeCl2固体,再次闭合开关,指针向左偏转(最后读数变为零)。
【查阅资料】灵敏电流计指针总是偏向电源正极;原电池中存在内阻,会影响反应进程。
请回答:
(1)步骤①中,开始时指针向_____(填“左"或“右”)偏转,甲烧杯中发生的电极反应式____________________。
(2)经步骤①后,乙烧杯溶液中新增金属阳离子____________(填离子符号)。
(3)步骤④中指针向左偏转,乙烧杯中发生的电极反应式______________________。
(4)要证明2Fe3++2I-![]() 2Fe2++I2 为可逆反应,你认为上述实验步骤不必做的是______________(填序号)。
2Fe2++I2 为可逆反应,你认为上述实验步骤不必做的是______________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g)![]() 2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
2NH3(g)ΔH=-92.4kJ/mol起始反应物为N2和H2物质的量之比为1:3,且总物质的量不变,在不同压强和濫度下,反应达到平衡时体系中NH3的物质的量分数如下表:
温度 物质的量分数 压强 | 400℃ | 450℃ | 500℃ | 600℃ |
20MPa | 0.387 | 0.274 | 0.189 | 0.088 |
30MPa | 0.478 | 0.359 | 0.260 | 0.129 |
下列说法正确的是
A. 体系中NH3的物质的量分数越大,则正反应速率越大
B. 反应达到平衡时,N2和H2的转化率之比均为1
C. 反应达到平衡时,放出的热量均为92.4kJ
D. 600℃,30MPa下反应达到平衡时,生成NH3的物质的量最多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用金属钠和空气制备纯度较高的过氧化钠,可利用的装置如下图所示。
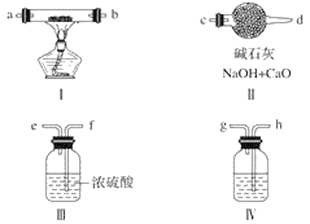
请回答下列问题:
(1)装置Ⅳ中盛放的药品是______________,其作用是______________。
(2)若规定气体的气流方向从左到右,则组合实验装置时各件仪器的正确连接顺序为(按从左到右顺序写明仪器的编号Ⅰ、Ⅱ……)______________,各仪器接口的标号字母(a、b……)顺序是空气进入__________,接__________,接__________,接__________。______________
(3)装置Ⅱ的作用是______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com