
已知热化学方程式:2H2(g)+O2(g)===2H2O(g)ΔH1=-483.6kJ/mol
则对于热化学方程式:2H2O(l)===2H2(g)+O2(g)ΔH2=QkJ/mol
下列说法正确的是
A.热化学方程式中化学计量数表示分子个数 B.Q = 483.6
C.Q > 483.6 D.Q < 483.6
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源:2017届河北省高三上期中化学卷(解析版) 题型:选择题
NaCl是一种化工原料,可以制备一系列物质(如下图所示)。下列说法正确的是
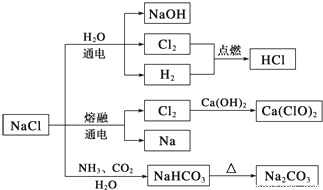
A.由氯化钠制备纯碱的过程中,利用了物质溶解度的差异
B.用Cl2制备漂白粉时,是将Cl2通入澄清石灰水中
C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应
D.图示转化反应都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上月考三化学试卷(解析版) 题型:选择题
下列表示的是异丙基的是( )
A.CH3CH2CH3
B.CH3CH2CH2﹣
C.﹣CH2CH2CH2﹣
D.(CH3)2CH﹣
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高一上月考二化学卷(解析版) 题型:选择题
NA为阿伏伽德罗常数的值。下列说法正确的是
A.1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.2NA
B.2 L 0.5mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
C.18g H2O含有10NA个质子
D.标准状况下,11.2L苯中含有分子的数目为0.5NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上期中选修化学卷(解析版) 题型:填空题
原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子, W基态原子的除第四层只有1个电子外,其余内层均为全满结构。
W基态原子的除第四层只有1个电子外,其余内层均为全满结构。
(1)W基态原子的价电子排布式为 。元素X、Y、Z的第一电离能由小到大顺序是 (填元素符号)。
(2)与XYZ-互为等电子体的一种分子为 (填化学式)。
(3)1 mol H2XZ3分子中含有σ键的数目为 。
(4)YH3极易 溶于水的主要原因是 。
溶于水的主要原因是 。
(5)尿素(H2NCONH2)可用于制有机铁肥,主要代表有 [Fe(H2NCONH2)6](NO3)3 [三硝酸六尿素合铁(Ⅲ)]。
①尿素分子中C、N原子的杂化方式分别是 。
②[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是 。根据价层电子对互斥理论推测NO3—的空间构型为 。

(6)CO2和NH3是制备尿素的重要原料,固态CO2(干冰)的晶胞结构如图所示。
①1个CO2分子周围等距离且距离最近的CO2分子有 个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上期中选修化学卷(解析版) 题型:选择题
电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。下列有关电池的叙述正确的是
A.原电池反应均是自发的氧化还原反应
B.氢氧燃料电池工作时氢气在正极被 氧化
氧化
C.氢氧燃料电池是将热能转变为电能的装置
D.铅蓄电池在放电 过程中,负极质量减小,正极质量增加
过程中,负极质量减小,正极质量增加
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上期中选修化学卷(解析版) 题型:选择题
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A.加热 B.滴加少量CuSO4溶液
C.加入硝酸钠固体 D.不用铁片,改用铁屑
查看答案和解析>>
科目:高中化学 来源:2017届湖南省高三上月考三化学试卷(解析版) 题型:选择题
向某密闭容器中加入0.3molA,0.1molC和一定量的B三种气体,一定条件下发生反应,各物质的浓度随时间如甲图所示[已知t~t1阶段 c( B)未画出]。乙图为 t2时刻后改变容器中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件且互不相同.t3时刻为使用催化剂.下列说法中正确的是
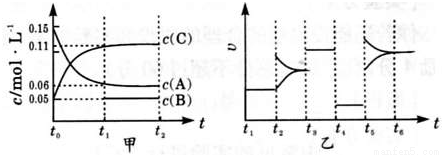
A.若t0=15 s,则用C的浓度变化表示的t0~t1段的平均反应速率为0.004mol•L-1•s-1
B.t4~t5阶段改变的条件一定为减小压强
C.该容器的容积为2 L,B的起始物质的量为0.02mol
D.t5~t6如阶段,容器内A的物质的量减少了0.06 mol,而此过程中容器与外界的热交换总量为a kJ,该反应的热化学方程式为3A(g) B(g)+2C(g)△H=-50akJ•mol-1
B(g)+2C(g)△H=-50akJ•mol-1
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三上期中化学试卷(解析版) 题型:推断题
4种相邻主族短周期元素的相对位置如表,元素x的原子核外电子数是m的2倍,y的氧化物具有两性。
|
| m | n |
x | y |
|
|
回答下列问题:
(1)元素x在周期表中的位置是 ,其单质可采用电解熔融 的方法制备。
(2)气体分子(mn)2的电子式为 ,(mn)2称为拟卤素,性质与卤素相似,其与氢氧化钠溶液反应的化学方程式为 。
(3)已知氰化钠(NaCN),可以与很多金属形成络合物,因此工业上采用氰化法提炼金:用稀的氰化钠溶液处理粉碎了的金矿石,通入空气,使金矿石中的金粒溶解,生成能溶于水的络合物Na[Au(CN)2],其反应方程式为:①4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,Na[Au(CN)2]在水溶液中的电离方程式为:②Na[Au(CN)2]=Na++[Au(CN)2]-,然后再用锌从溶液中把金置换出来,锌转化为Na2[Zn(CN)4]。据此,请利用①写出在空气中用氰化钠溶液提取金的电极反应式:正极: ,负极: 。
(4)若人不慎氰化钠中毒,可用Na2S2O3缓解,二者反应得到两种含硫元素的离子,其中一种遇到Fe3+可变为红色。写出解毒原理的相关离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com