
| 物质 | Kap(25℃) | 颜色 |
| PbSO4 | 1.8×10-8 | 白色 |
| PbCO3 | 1.5×10-13 | 白色 |
| PbCrO4 | 1.8×10-14 | 黄色 |
| BaCrO4 | 1.2×10-10 | 黄色 |
| Pb(OH)2 | 1.8×10-20 | 白色 |
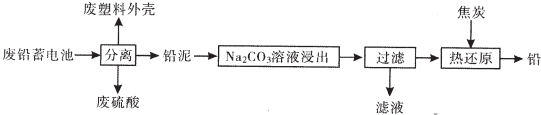
分析 废铅蓄电池经分离得到铅泥,加入碳酸钠溶液可生成碳酸铅,过滤后加入碳高温可生成铅.
(1)铅蓄电池较为笨重,且可引起重金属污染;
(2)塑料燃烧可提供热能,热能转化为机械能可发电;
(3)溶液经蒸发浓缩、冷却结晶可得到晶体;
(4)(CH3COO)2Pb溶液与KC10在强碱性条件下反应制取Pb02,同时生成氯离子、CH3COO-;
(5)反应CO32-(aq)+PbSO4(s)?PbCO3(s)+SO42-(aq)的平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c(P{b}^{2+})c(S{{O}_{4}}^{2-})}{c(P{b}^{2+})c(C{{O}_{3}}^{2-})}$;
(6)可加入过量KOH溶液鉴别,能溶解的为PbCr04.
解答 解:废铅蓄电池经分离得到铅泥,加入碳酸钠溶液可生成碳酸铅,过滤后加入碳高温可生成铅.
(1)铅蓄电池较为笨重,且可引起重金属污染,所以比能量低,故答案为:比能量低;
(2)塑料燃烧可提供热能,热能转化为机械能可发电,类似于煤的发电原理,故答案为:热能;机械能;
(3)溶液经蒸发浓缩、冷却结晶可得到晶体,故答案为:蒸发浓缩;冷却结晶;
(4)(CH3COO)2Pb溶液与KC10在强碱性条件下反应制取Pb02,同时生成氯离子、CH3COO-,反应的离子方程式为(CH3COO)2Pb+ClO-+2OH-=PbO2↓+Cl-+2CH3COO-+H2O,故答案为:(CH3COO)2Pb+ClO-+2OH-=PbO2↓+Cl-+2CH3COO-+H2O;
(5)反应CO32-(aq)+PbSO4(s)?PbCO3(s)+SO42-(aq)的平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c(P{b}^{2+})c(S{{O}_{4}}^{2-})}{c(P{b}^{2+})c(C{{O}_{3}}^{2-})}$=$\frac{1.8×1{0}^{-8}}{1.5×1{0}^{-13}}$=1.2×10-5,
以滤渣PbCO3和焦炭为原料可制备金属铅,涉及反应为PbCO3$\frac{\underline{\;\;△\;\;}}{\;}$PbO+CO2↑、2PbO+C$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+CO2↑,
故答案为:1.2×10-5;PbCO3$\frac{\underline{\;\;△\;\;}}{\;}$PbO+CO2↑、2PbO+C$\frac{\underline{\;\;△\;\;}}{\;}$2Pb+CO2↑;
(6)Pb(OH)2是既能溶于稀硝酸,又能溶于KOH溶液的两性氢氧化物,则可加入过量KOH溶液鉴别,能溶解的为PbCrO4,
故答案为:取少量待测物于两支试管中,分别与过量KOH溶液反应,能溶解的是PbCr04,不溶解的是BaCr04.
点评 本题通过铅的制备流程,考查了物质制备方案的设计方法,题目难度中等,注意掌握物质制备方案的设计原则,正确分析制备流程得出物质的制备原理为解答此类题的关键,试题有利于提高学生的分析、理解能力及化学实验能力,试题的综合性较强,是一道质量较好的题目.


科目:高中化学 来源: 题型:选择题
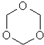 ),三聚甲醛可用作合成工程塑料等,还是日用化妆品冷烫精及脱毛剂的主要原料.下列有关三聚甲醛的说法中正确的是( )
),三聚甲醛可用作合成工程塑料等,还是日用化妆品冷烫精及脱毛剂的主要原料.下列有关三聚甲醛的说法中正确的是( )| A. | 三聚甲醛属于高分子化合物 | |
| B. | 三聚甲醛与甘油互为同分异构体 | |
| C. | 三分子甲醛合成三聚甲醛的反应属于加成反应 | |
| D. | 1 mol的三聚甲醛燃烧时生成CO2和H2O的物质的量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、NO3-、CO32- | B. | Na+、CO32-、Cu2+、Cl- | ||
| C. | K+、Na+、Cl-、NH4+ | D. | K+、Cl-、Ba2+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molCu与足量的S反应转移电子数为2NA | |
| B. | 46g有机物C2H6O中含有共价键的数目为7NA | |
| C. | 在0.5L2mol•L-1的Na2CO3溶液中含CO32-的数目为NA | |
| D. | 10gD2O和H218O的混合物中含有的中子数为5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
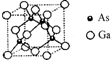 砷化镓晶体是半导体材料,应用于太阳能电池、LED光源和通讯领域.
砷化镓晶体是半导体材料,应用于太阳能电池、LED光源和通讯领域.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上现在大规模采用电解熔融NaCl或AlCl3制取Na或Al | |
| B. | 若电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化 | |
| C. | 某反应的平衡常数K300℃>K350℃,则该反应△H<0 | |
| D. | 合成氨生产中将NH3液化分离,目的是加快正反应速率,提高H2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
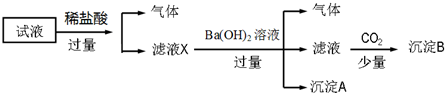
| A. | 原溶液中一定存在的离子为NH4+、Fe2+、NO3-和SO42- | |
| B. | 无法确定原试液中是否含有Fe3+、K+ | |
| C. | 滤液X中大量存在的阳离子有NH4+、Fe3+、H+和Al3+ | |
| D. | 无法确定沉淀B的成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数c>d | B. | 非金属性Y<Z | ||
| C. | 氢化物的稳定性H2Y>HZ | D. | 原子半径W>X |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com