
 研究硫及其化合物性质有重要意义.
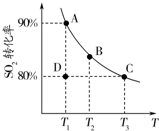
研究硫及其化合物性质有重要意义.分析 (2))状态D时的SO2的转化率为80%,未达到90%,反应向正反应进行;
根据SO3平衡时的浓度,利用三段式计算平衡时各组分的平衡浓度,代入平衡常数计算;
在T3温度时,达平衡时测得反应放出的热量为Q1.此时再向容器中加入2mol SO2、1mol O2,平衡向正反应方向移动,放出的热量增大,等效为增大压强,平衡向正反应方向移动,反应物的转化率增大.平衡常数只与温度有关,由图可知,温度越高SO2的转化率越小,即升高温度平衡向逆反应移动,平衡常数降低;
(3)选择由氧化性的试剂,检验二氧化硫的还原性,且现象明显;
选择碱溶液,检验二氧化硫是酸性氧化物,且现象明显;
(4)Na2SO3溶液变质,会有Na2SO4生成,取少许溶液加入用盐酸酸化的BaCl2溶液,通过观察是否有白色沉淀生成确定是否变质.
解答 解:(2)状态D时的SO2的转化率为80%,未达到90%,反应向正反应进行,v正>v逆;
T1温度下,反应达到平衡状态,SO2的转化率为90%,则SO2的浓度变化为1mol/L×90%=0.9mol•L-1,
2SO2(g)+O2(g)?2SO3(g).
开始(mol/L):1 0.5 0
变化(mol/L):0.9 0.45 0.9
平衡(mol/L):0.1 0.05 0.9
所以该温度下平衡常数K=$\frac{0.{9}^{2}}{0.{1}^{2}×0.05}$=1620;
在T3温度时,达平衡时测得反应放出的热量为Q1.此时再向容器中加入2mol SO2、1mol O2,平衡向正反应方向移动,放出的热量增大,等效为增大压强,平衡向正反应方向移动,反应物的转化率增大,故容器内压强小于原来的2倍,放出的热量Q2>Q1,故ab错误,c正确;平衡常数只与温度有关,由图可知,温度越高SO2的转化率越小,即升高温度平衡向逆反应移动,平衡常数降低,故d错误;
故答案为:>;1620;c;
(3)溴水检验强氧化性,氧化二氧化硫,溶液颜色褪去,可以用溴水验证二氧化硫的还原性;
二氧化硫与氢氧化钠溶液、氢氧化钙溶液都放出反应生成亚硫酸盐与水,亚硫酸钠溶于水,亚硫酸钙为白色沉淀,故二氧化硫与氢氧化钠溶液反应选项不明显,可以用氢氧化钙溶液验证SO2具有酸性氧化物的性质,
故答案为:d;b;
检验二氧化硫是酸性氧化物,且现象明显;
(4)Na2SO3溶液变质,会有Na2SO4生成,取少许溶液加入用盐酸酸化的BaCl2溶液,若出现白色沉淀,则Na2SO3溶液变质,若不出现白色沉淀,则Na2SO3溶液未变质,
故答案为:加入用盐酸酸化的BaCl2溶液;若出现白色沉淀,则Na2SO3溶液变质,若不出现白色沉淀,则Na2SO3溶液未变质.
点评 本题考查化学平衡的计算,题目难度中等,涉及化学平衡图象与影响因素、化学平衡常数计算、硫化合物的性质、实验方案设计等,题目较为综合,是对知识的综合利用,(2)中注意利用等效平衡分析,试题培养了学生的分析、理解能理解及化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 溴水中当加入硝酸银溶液后,溶液颜色变浅 | |
| B. | 高压比常压有利于工业合成氨反应 | |
| C. | 红棕色NO2加压后颜色比原来要深 | |
| D. | 热的纯碱除油污效果好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| I | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| II | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| III | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| Ⅳ | a>x≥c | 无明显变化 | 有Cl2 |
| Ⅴ | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
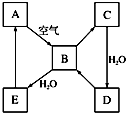 如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).B和C的相对分子质量相差16,化合物D是重要的工业原料.
如图表示某淡黄色固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).B和C的相对分子质量相差16,化合物D是重要的工业原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3 | B. | O2 | C. | H2O | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B物质的量浓度 | B. | 混合气体的密度 | ||
| C. | 混合气体的压强 | D. | 混合气体的平均相对分子量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
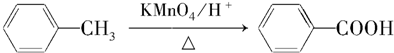

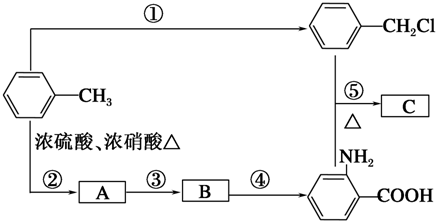
 、A物质的结构简式是
、A物质的结构简式是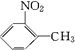 .
.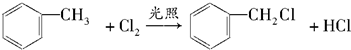 ,取代反应
,取代反应 ,取代反应.
,取代反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com