
| 绿矾 |
| H+ |
| 石灰水 |


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:
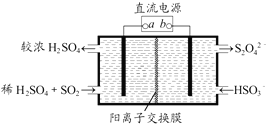
| A、a为直流电源的负极 |
| B、阴极的电极反应式为:2HSO3-+2H++e-═S2O42-+2H2O |
| C、阳极的电极反应式为:SO2+2H2O-2e-═SO42-+4H+ |
| D、电解时,H+由阴极室通过阳离子交换膜到阳极室 |
查看答案和解析>>
科目:高中化学 来源: 题型:
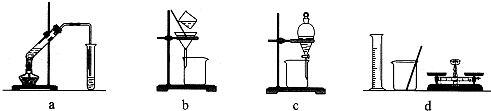
| A、a组:制备少量乙酸乙酯 |
| B、b组:除去粗盐水中的泥沙 |
| C、c组:用CCl4提取碘水中的碘 |
| D、d组:配制100 mL 1.00 mol/L NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
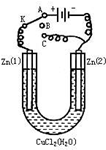 在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图:
在一个U形管里盛有氯化铜溶液,并插入两块纯锌片作电极,如图:查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象及相关结论 | |
| ① | 取少量电解质溶液于试管中,用pH试纸测其pH, | 试纸呈深蓝色,经比对溶液的pH约为14,说明溶液中有残余的KOH. |
| ② | 继续加入 |
若有白色沉淀产生,则溶液中含有K2SO4. 若无白色沉淀产生,则溶液中没有K2SO4. |
| ③ | 另取少量电解质溶液于试管中,先加 1mol?L-1的H2SO4酸化,再滴入2~3滴0.01mol?L-1KMnO4酸性溶液,振荡. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Mg2+、Clˉ、CO32ˉ |
| B、Na+、K+、CO32ˉ、OHˉ |
| C、NH4+、H+、OHˉ、ClOˉ |
| D、H+、NO3ˉ、Al3+、Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com