
【题目】NA为阿伏加德罗常数的数值,下列说法正确的是( )
A. 28g乙烯、丙烯的混合气体中所含原子数为6NA
B. 28g乙烯所含共用电子对数目为4NA
C. 标准状况下,11.2 L氯仿(CHCl3)所含分子数为0.5 NA
D. 78g苯中含有C—C键数目为3NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】乙烯是重要的化工原料,以乙烯为原料在不同条件下可合成下列物质(部分条件未标出):

(1)乙醇能与乙酸反应生成有果香味的物质,其名称为__________,该反应类型是____________
(2)反应⑥的化学方程式是______________实验现象是__________________
(3)反应③用KOH的乙醇溶液处理二氯乙烷制氯乙烯的方程式为:____________
(4)苯乙烯中所含官能团的名称_____________
(5)苯乙烯合成聚苯乙烯的化学方程式是_____________________
(6)以乙醇和苯乙烯为原料合成有机物![]() ,写出合成路线图_________________。
,写出合成路线图_________________。
(合成路线常用的表示方法为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,22.4LHCl气体溶于水,制成250mL溶液,所得溶液中氯化氢物质的量浓度为_____;若将该盐酸再稀释成1L溶液A,则其氯化氢的物质的量浓度变为_________;
(2)从A溶液取出250mL盐酸与足量Zn反应,在标准状况下可生成多少体积的气体?(根据化学方程式计算)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)有下列几组物质或原子:①612C和614C②H③Na2O2④P⑤N⑥H2⑦O2和O3⑧烧碱、纯碱及苛性钠。选择适当的序号回答有关问题:
(1)属于第二周期ⅤA族的元素是_____________;
(2)含有非极性键的离子化合物是_____________;
(3)互为同位素的是_____________;
(4)原子半径最小的原子形成的分子是_____________;
(5)属于同素异形体的是_____________。
(II)用合理的化学用语回答下列问题
(1)甲烷分子的电子式:_____________;
(2)乙烯分子的结构简式:_____________;
(3)甲烷和氯气光照生成一氯甲烷方程式:_____________;
(4)苯和液溴在铁屑催化下反应生成溴苯方程式:_____________;
(5)乙醇和金属钠反应生成乙醇钠方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产含氯有机物时会产生HCl,利用反应4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g)可实现氯的循环利用。完成下列填空:
2Cl2(g)+2H2O(g)可实现氯的循环利用。完成下列填空:
(1)上述反应若在固定体积的密闭容器中发生,能说明反应已达平衡的是_________(选填序号)。
a.2ν(HCl)正=ν(Cl2)逆 b.体系压强不再改变
c.混合气体密度不变 d.K=![]()
(2)二氯化二硫(S2C12)可用作橡胶工业的硫化剂,它的分子结构与H2O2相似。下列有关说法不正确的是___(选填序号)。
a.S2C12分子中有4对共用电子对 b.S2C12分子中没有非极性键
c.S2C12分子中,S为+1价,Cl为-1价 d.S2C12分子中各原子均为8电子稳定结构。
(3)已知X2(g)+H2(g)![]() 2HX(g)+Q(X2表示Cl2、Br2)如图表示上述反应的平衡常数K与温度T的关系。
2HX(g)+Q(X2表示Cl2、Br2)如图表示上述反应的平衡常数K与温度T的关系。
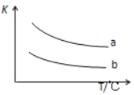
①Q表示X2(g)与H2(g)反应的反应热,Q____0(填“>”、“<”或“=”)。
②写出曲线b表示的平衡常数K的表达式,K=_________________(表达式中写物质的化学式)。
(4)向新制的氯水中加入少量下列物质,能增强溶液漂白能力的是(_______)
A.氯化钙 B.碳酸钙粉末 C.二氧化硫溶液 D.稀硫酸
(5)若向氯化银沉淀中逐渐滴加HBr,会看到白色沉淀逐渐变为淡黄色沉淀现象,请用溶解平衡原理解释此现象____。
(6)已知BBr3与BI3的空间构型是平面三角形结构,则它们是____分子(填极性或非极性),且BBr3的沸点低于BI3,原因是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究乙醇氧化的反应机理,某研究性学习小组的学生设计了下列实验方案:将一根粗铜丝绕成螺旋状,称得其质量为m1g。另取一支试管,加入3mL乙醇。
(1)将上述已称量过的铜丝放在酒精灯火焰上加热至红热后稍冷,可看到铜丝______(填写现象),再称得其质量为m2g,并且m2________m1(填大于、小于或等于)。
(2)若将红热的铜丝伸入试管中的酒精溶液中,可看到铜丝__________(填写现象)。
(3)反复多次,可闻到试管里溶液有刺激性气味。最后将从酒精中取出的铜丝烘干后称量,其质量为m3g,则m3________m1(填写大于、小于或等于)。
(4)此实验总的化学反应方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础。下列与“物质的量”相关的计算正确的( )
A.现有CO、CO2、O3三种气体,它们分别都含有1molO,则三种气体的物质的量之比为 3∶2∶1
B.5.6g CO 和22.4L CO2中含有的碳原子数一定相等
C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D.n g Cl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为 35.5m/n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶性显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料,也是一种半导体材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。请回答:
(1)Y在元素周期表中的位置是________。
(2)Y的最高氧化物相应水化物具有______(填“酸性”、“碱性”、“两性”)。并写出其电离方程式______。
(3)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈__性(填“酸”、“碱”或“中”),用离子方程式表示其原因是__。
(4)Z和W比较,非金属性较弱的是_______(填元素符号)。下列可以验证这一结论的是_______(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.氢化物的水溶性
d.Z与W以共价键形成化合物时,Z或W显示的化合价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯催化氧化成乙醛可设计成如下图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是
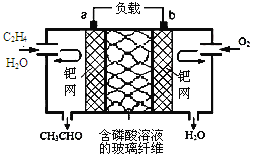
A.a电极发生还原反应
B.放电时,每转移2mol电子,理论上需要消耗28g乙烯
C.b极反应式为:O2+4e-+2H2O=4OH-
D.电子移动方向:电极a→磷酸溶液→电极b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com