
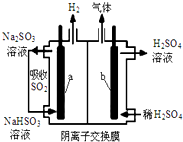
 电解法在污染处理上有广泛应用,下面是两例具体应用.
电解法在污染处理上有广泛应用,下面是两例具体应用.

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
A、向碳酸氢钙溶液中加入过量的氢氧化钠:Ca2++2OH-+2HCO
| ||||
B、等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH-+NH
| ||||
| C、氢氧化铝与足量的盐酸反应:Al(OH)3+3H+=Al3++3H2O | ||||
D、向Na2SiO3溶液中通入过量CO2:SiO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
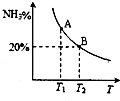 合成氨技术的发明使工业化人工固氮成为现实.
合成氨技术的发明使工业化人工固氮成为现实.| 温度/℃ CO2转化率%
|
100 | 150 | 200 | ||
| 1 | 19.6 | 27.1 | 36.6 | ||
| 1.5 | a | b | c | ||
| 2 | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:
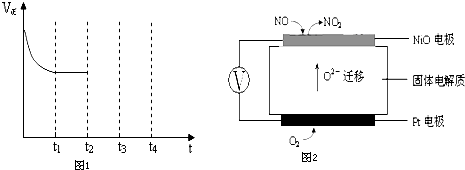
| 催化剂 |
投料比[
| 400K | 500K | 600K | ||
| 1 | 60% | 43% | 28% | ||
| 2 | 45% | 33% | 20% |
| n(NO2) |
| n(CH4) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
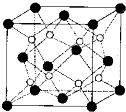 (1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未 成对的电子,w的原子序数为29.回答下列问题:
(1)原子序数小于36的X、Y、Z、W四种元素,其中X是元素周期表原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未 成对的电子,w的原子序数为29.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
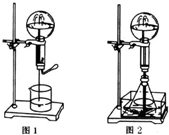 喷泉是一种常见的自然现象,其产生原因是存在压强差.
喷泉是一种常见的自然现象,其产生原因是存在压强差.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com