
氮、磷及其化合物在生产、生活中有重要的用途。回答下列问题:
I (1)直链聚磷酸是由n个磷酸分子通过分子间脱水形成的,常用于制取阻燃剂聚磷酸铵。
①写出磷酸主要的电离方程式________________________。
②直链低聚磷酸铵的化学式可表示为(NH4)(n+2)PnOx,x=_____(用n表示)。
(2)在碱性条件下,次磷酸盐可用于化学镀银,完成其反应的离子方程式。
□H2PO2-+□Ag++□______=□PO43-+□Ag+□______
(3) 工业上生产硝酸铜晶体的流程图如下:
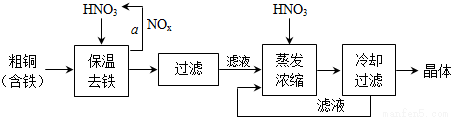
①在步骤a中,需要通入氧气和水,其目的是______.
②进行蒸发浓缩时,要用硝酸调节溶液的pH=1,其目的是(结合离子方程式说明)______.
③下图是某小组同学查阅资料所绘出的硝酸铜晶体[Cu(NO3)2•nH2O]的溶解度曲线(温度在30℃前后对应不同的晶体),下列说法正确的是______(填字母).
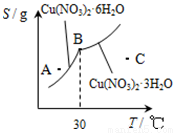
a.A点时的溶液为不饱和溶液
b.B点时两种晶体可以共存
c.按上述流程最终得到的晶体是Cu(NO3)2•3H2O
d.若将C点时的溶液降温至30℃以下,可以析出Cu(NO3)2•6H2O晶体
II (4)查阅资料可知:银氨溶液中存在平衡:Ag+(aq)+2NH3(aq) Ag(NH3)2+(aq),该反应平衡常数的表达式K稳[Ag(NH3)2+]= _________,已知某温度下,K稳[Ag(NH3)2+]=1.10×107,Ksp[AgCl]=1.45×10﹣10。计算得到可逆反应AgCl(s)+2NH3(aq)
Ag(NH3)2+(aq),该反应平衡常数的表达式K稳[Ag(NH3)2+]= _________,已知某温度下,K稳[Ag(NH3)2+]=1.10×107,Ksp[AgCl]=1.45×10﹣10。计算得到可逆反应AgCl(s)+2NH3(aq) Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_________ (保留2位有效数字),1L 1mol/L氨水中最多可以溶解AgCl_________mol(保留1位有效数字)。
Ag(NH3)2+(aq)+Cl-(aq)的化学平衡常数K=_________ (保留2位有效数字),1L 1mol/L氨水中最多可以溶解AgCl_________mol(保留1位有效数字)。
科目:高中化学 来源:2015-2016学年山东省临沂市高一下学期期中考试化学试卷(解析版) 题型:选择题
已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )

A.该反应为吸热反应
B.该反应为放热反应
C.反应物的总能量高于生成物的总能量
D.该反应只有在加热条件下才能进行
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三八模理综化学试卷(解析版) 题型:填空题
有机物DBP常用作纤维素树脂和聚氯乙烯的增塑剂,特别适用于硝酸纤维素涂料。具有优良的溶解性、分散性和粘着性。由有机物A和邻二甲苯为原料可以合成DBP。
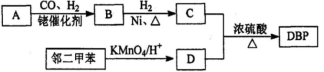
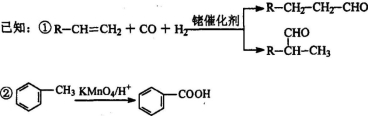
③烃A是有机合成的重要原料。A的质谱图表明其相对分子质量为42,红外光谱表明分子中含有碳碳双键;B能发生银镜反应;有机物C的核磁共振氢谱显示其分子中含有5种化学环境不同的氢原子,且个数之比为3:2:2:2:l。回答下列问题:
(1)A的结构简式为________;A在一定条件下生成聚合物的化学方程式为___________________
(2)D中的含氧官能团是___________。有机物D和足量有机物C反应生成DBP的化学方程式是____________________________________________
(3)下列说法正确的是___________ (选填序号字母)。
A.A能发生聚合反应、加成反应和氧化反应
B.与C互为同分异构体,且含有相同官能团的有机物有2种
C.邻二甲苯能氧化生成D说明有机物分子中基团之间存在影响
D.1 mol DBP可与含4mol NaOH的溶液完全反应
(4)工业上常用有机物E(C8H4O3)代替D生产DBP。反应分为两步进行:
i)E+C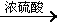 中间产物
中间产物
ii)中间产物+C 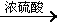 DBP+H2O
DBP+H2O
①请写出E的结构简式___________。
②工业上生产有机物E的反应如下:2X+9O2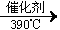 2E+4CO2+4H2O,芳香烃X的一溴代物只有两种,则X的结构简式是___________。
2E+4CO2+4H2O,芳香烃X的一溴代物只有两种,则X的结构简式是___________。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三全真模拟理综化学试卷(解析版) 题型:填空题
铁是一种过渡元素,金属铁是最常用的金属。请回答下列各题:
(1)生铁中含有一种铁碳化合物(Fe3C),在足量的空气中高温煅烧,生成有磁性的固体和能使澄清石灰水变浑浊的气体,该反应的化学方程式为 。上述反应生成的磁性固体能溶于过量盐酸,该反应的离子方程式为 。
(2)在Fe2+或Fe3+的催化作用下,可实现2SO2+O2+2H2O=2H2SO4的转化。已知含SO2的废气通入含Fe2+的溶液时,其中一个反应的离子方程式为2Fe3+ + SO2 + 2H2O = 2Fe2+ + SO42- + 4H+,则另一反应的离子方程式为 。
(3)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制绿矾。利用烧渣制绿矾的过程如下:
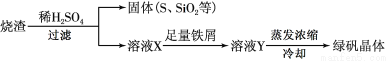
①烧渣溶于稀H2SO4过程中,先是固体大部分被溶解,接着有单质硫生成,写出该反应的离子方程式(只写生成S的离子方程式,其他反应无需写出) 。
②向溶液X中加入足量铁屑的目的是 。
③取1.6g所得晶体样品配成溶液,滴入 mL 0.1000 mol/L 的酸性高锰酸钾液刚好完全反应,经计算可得样品中含47.5%的硫酸亚铁。
(4)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH=3时,通过计算说明Fe3+是否沉淀完全 。
(提示:当某离子浓度小于1.0×10-5 mol•L-1时可以认为该离子沉淀完全了)
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三全真模拟理综化学试卷(解析版) 题型:选择题
下列叙述错误的是 ( )
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③ⅡA族元素的阳离子与上周期稀有气体元素的原子具有相同的核外电子排布
④元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
⑤多电子原子中,在离核较近的区域内运动的电子能量较高
⑥已知H2SO4(aq)+2NaOH(aq)=2H2O(l)+Na2SO4(aq)△H=﹣114.6kJ·mol﹣1 则中和热为57.3kJ·mol﹣1
⑦两个非金属元素原子间只可能形成共价键,而含金属元素的化合物中一定含离子键.
A.②④⑥ B.①⑤⑥ C.①⑤⑦ D.②③④
查看答案和解析>>
科目:高中化学 来源:2016届湖北省沙市、沙市五中高考模拟理综化学试卷(解析版) 题型:选择题
瑞典ASES公司设计的曾用于驱动潜艇的液氨—液氧燃料电池示意图如图所示,下列有关说法正确的是
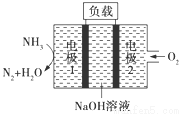
A.电池工作时,Na+向电极1移动
B.电池工作一段时间后停止,溶液pH值不变
C.电极1发生的电极反应为2NH3+6OH--6e-===N2↑+6H2O
D.用该电池做电源电解精炼铜,理论上每消耗0.2 mol NH3 的同时阳极会得到19.2g纯铜
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:填空题
短周期元素X、Y、Z、W的原子序数依次增大,X的原子半径比Y小,X与W同主族,Z是地壳中含量最高的元素。X、Y、Z、W原子最外层电子数之和为13。问:
(1)X是 Y是 Z是 W是 (填元素符号)
(2)写出W的最高价氧化物对应的水化物的电子式 ,写出Y的简单氢化物的电子式 。
(3)Y的最高价氧化物对应的水化物的浓溶液久置后呈现黄色,写出发生反应的化学方程式 。
(4)实验室制取Y的氢化物的方程式 ,该反应 (填“是”或“不是”)氧化还原反应。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高一下期中化学试卷(解析版) 题型:选择题
某主族元素R的原子的电子式可表示为: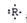 ;该元素组成的以下物质,其化学式肯定错误的是( )
;该元素组成的以下物质,其化学式肯定错误的是( )
A.最高价氧化物分子式为R2O5 B.含氧酸分子式为HRO3
C.含氧酸分子式为H3RO4 D.气态氢化物分子式为RH5
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖南省高二下期中理科化学试卷(解析版) 题型:选择题
对相同状况下的12C18O和14N2两种气体,下列说法正确的是
A.若质量相等,则质子数相等
B.若原子数相等,则中子数相等
C.若分子数相等,则体积相等
D.若体积相等,则密度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com