
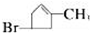
 .化合物A~H的转化关系如图所示,B1和B2互为同分异构体,B1的摩尔质量80g/mol;G1和G2互为同分异构体,核磁共振氢谱显示二者均只有两种氢,G1无甲基.请完成下列问题.
.化合物A~H的转化关系如图所示,B1和B2互为同分异构体,B1的摩尔质量80g/mol;G1和G2互为同分异构体,核磁共振氢谱显示二者均只有两种氢,G1无甲基.请完成下列问题.
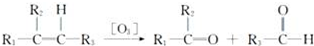
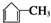 ,G2所含官能团为醛基、羰基.
,G2所含官能团为醛基、羰基.
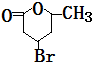 +H2O.
+H2O.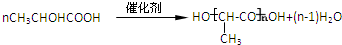 .
.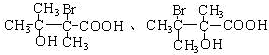 任意一种.
任意一种.分析 根据题中信息可知A发生氧化后生成C,C为OHCCH2CHBrCH2COCH3,C氧化生成D,则D为HOOCCH2CHBrCH2COCH3,D与氢气发生加成反应生成E,则E为HOOCCH2CHBrCH2CH(OH)CH3,F为六元环化合物,应是E发生酯化反应生成F,则F为 .B2是A的消去产物,其分子式为C6H8,B2臭氧化后得到G1和G2互为同分异构体,二者的核磁共振氢谱均只有两种氢环境,G1无甲基,则B2为
.B2是A的消去产物,其分子式为C6H8,B2臭氧化后得到G1和G2互为同分异构体,二者的核磁共振氢谱均只有两种氢环境,G1无甲基,则B2为 ,B1是
,B1是 ,G1为OHC-CH2-CHO,G2为OHCCOCH3,由转化关系可知H为HOOCCH(OH)CH3,据此解答.
,G1为OHC-CH2-CHO,G2为OHCCOCH3,由转化关系可知H为HOOCCH(OH)CH3,据此解答.
解答 解:根据题中信息可知A发生氧化后生成C,C为OHCCH2CHBrCH2COCH3,C氧化生成D,则D为HOOCCH2CHBrCH2COCH3,D与氢气发生加成反应生成E,则E为HOOCCH2CHBrCH2CH(OH)CH3,F为六元环化合物,应是E发生酯化反应生成F,则F为 .B2是A的消去产物,其分子式为C6H8,B2臭氧化后得到G1和G2互为同分异构体,二者的核磁共振氢谱均只有两种氢环境,G1无甲基,则B2为
.B2是A的消去产物,其分子式为C6H8,B2臭氧化后得到G1和G2互为同分异构体,二者的核磁共振氢谱均只有两种氢环境,G1无甲基,则B2为 ,B1是
,B1是 ,G1为OHC-CH2-CHO,G2为OHCCOCH3,由转化关系可知H为HOOCCH(OH)CH3.
,G1为OHC-CH2-CHO,G2为OHCCOCH3,由转化关系可知H为HOOCCH(OH)CH3.
(1)由上述分析可知,B1的结构简式为 ,G2为OHCCOCH3,所含官能团为醛基、羰基,
,G2为OHCCOCH3,所含官能团为醛基、羰基,
故答案为: ;醛基、羰基;
;醛基、羰基;
(2)反应⑤是A发生消去反应生成B1和B2,故答案为:消去反应;
(3)反应④的化学方程式为:HOOCCH2CHBrCH2CH(OH)CH3
 +H2O,
+H2O,
故答案为:HOOCCH2CHBrCH2CH(OH)CH3
 +H2O;
+H2O;
(4)C(OHCCH2CHBrCH2COCH3 )与新制Cu(OH)2悬浊液 反应的方程式为:OHCCH2CHBrCH2COCH3+2Cu(OH)2$\stackrel{△}{→}$HOOCCH2CHBrCH2COCH3+Cu2O↓+2H2O,
故答案为:OHCCH2CHBrCH2COCH3+2Cu(OH)2$\stackrel{△}{→}$HOOCCH2CHBrCH2COCH3+Cu2O↓+2H2O;
(5)一定条件下H[HOOCCH(OH)CH3]能够生成高分子化合物,该反应的方程式为: ,
,
故答案为: ;
;
(6)E(HOOCCH2CHBrCH2CHOHCH3)的同分异构体中①含有三个甲基;②与E所含官能团相同; ③-OH和-Br不连在同一个碳原子上,则符合条件的E的同分异构体为: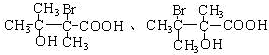 ,
,
故答案为:2;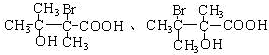 任意一种.
任意一种.
点评 本题考查有机物的推断和合成,题目较为综合,注意充分利用题目给予的信息,采用正、逆推法相结合的方法推断,需要学生熟练掌握官能团的性质与转化,对学生逻辑推理有较高的要求.


科目:高中化学 来源: 题型:选择题
| A. |  用装置除去乙酸乙酯中混有的少量乙酸 | |
| B. |  用装置除去氯气中的少量氯化氢 | |
| C. | 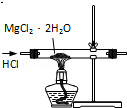 用装置制取无水MgCl2 | |
| D. |  用装置制取乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
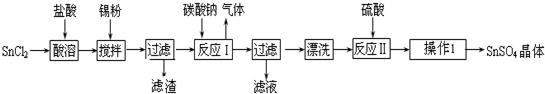
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
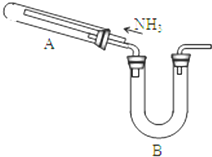 某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如图.
某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如图.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
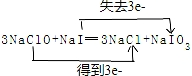 ,还原剂与氧化剂的物质的量之比是1:3.
,还原剂与氧化剂的物质的量之比是1:3.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
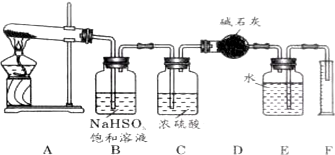
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③⑤ | C. | ①②⑤ | D. | ①③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com