15.NH
3在与酸反应、与盐溶液反应时体现出碱性外,还有其它性质.

( I)(1)同学甲在百度中查阅工业制硝酸的原理:硝酸工业与合成氨工业密接相关,氨氧化法是工业生产中制取硝酸的主要途径,其主要流程是将氨和空气的混合气(氧:氮≈2:1)通入灼热(760~840℃)的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮(NO).生成的一氧化氮利用反应后残余的氧气继续氧化为二氧化氮,随后将二氧化氮通入水中制取硝酸.稀硝酸、浓硝酸、发烟硝酸的制取在工艺上各不相同.反应在高温高压条件下进行.同学乙认为只要增大氧气的含量,就可以直接氧化得到NO
2,再制备硝酸.请结合你所学习的化学知识,谈谈实际生产中的合理性.已知:2NO与O
2反应生成2NO
2是可逆反应.氨和空气的混合气在合金网的催化下,氨被氧化成一氧化氮(NO),氧气继续氧化为二氧化氮,反应增大氧气的含量,可以促使化学反应正向移动,从而提高硝酸的产率
(2)工业上,NaNH
2用于制取靛青染料;LiNH
2主要用于有机合成和药物制造,是具有良好前景的储氢材料.科学家在液氨中加入金属钠或金属锂制备NaNH
2和LiNH
2,试写出制备LiNH
2反应方程式:Li+2NH
3=LiNH
2+2H
2,NH
3表现氧化性.
(3)已知NH
3与Cl
2在一定条件下能发生反应,其中N元素被氧化为游离态,实际反应中其产物随着n(NH
3):n(Cl
2)的比发生变化,经测定,产物中n(HCl):n(NH
4Cl)=1:1时,则n(NH
3):n(Cl
2)=5:3,整个反应过程被氧化的N与未被氧化的N物质的量之比为2:3结合以上信息,请写出工业上检验氯气管道是否漏气的方法及现象:取浓氨水洒于管道口,产生白烟,证明此处漏气
( II)二氧化氯(ClO
2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
(1)目前已开发出用电解法制取ClO
2的新工艺.
①如图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO
2.写出阳极产生ClO
2的电极反应式:Cl
--5e
-+2H
2O=ClO
2↑+4H
+.
②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为0.01mol;用平衡移动原理解释阴极区pH增大的原因在阴极发生2H
++2e
-=H
2↑,H
+浓度减小,使得H
2O?OH
-+H
+的平衡向右移动,OH
-浓度增大,pH增大.
(2)ClO
2对污水中CN
-有明显的去除效果.某工厂污水中含CN
- a mg/L,现用ClO
2将CN
-氧化,只生成两种常见气体,其离子反应方程式为2ClO
2+2CN
-=N
2↑+2CO
2↑+2Cl
-;处理100m
3这种污水,至少需要ClO
2$\frac{50a}{13}$mol.

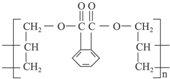 合成它的单体可能有( )
合成它的单体可能有( )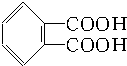 ) ②丙烯醇(CH2═CH-CH2OH)
) ②丙烯醇(CH2═CH-CH2OH)  阅读快车系列答案
阅读快车系列答案
