
| A. | OH-+CO32-+2H+═HCO3-+H2O | B. | 2OH-+CO32-+3H+═HCO3-+2H2O | ||
| C. | OH-+CO32-+3H+═CO2↑+2H2O | D. | 2OH-+CO32-+4H+═CO2↑+3H2O |
分析 等物质的量浓度的NaOH和Na2CO3的混合溶液中含有氢氧化钠与碳酸钠的物质的量相等,稀盐酸加入到NaOH和Na2CO3的混合溶液中,盐酸先与氢氧化钠发生酸碱中和,剩余的盐酸再与碳酸钠发生反应,盐酸少量时发生反应CO32-+H+=HCO3-,盐酸过量时发生反应:CO32-+2H+=CO2↑+H2O,以此来解答.
解答 解:A.设NaOH和Na2CO3的物质的量都为1mol,则加入盐酸少量,先发生反应:OH-+H+→H2O,1mol氢氧化钠消耗1mol盐酸,再发生反应CO32-+H+→HCO3-,将两个方程式相加得:OH-+CO32-+2H+=HCO3-+H2O,故A正确;
B.设NaOH和Na2CO3的物质的量都为2mol,则加入盐酸少量,先发生反应:2OH-+2H+→2H2O,2mol氢氧化钠消耗2mol盐酸,再发生反应CO32-+H+→HCO3-,盐酸不足之消耗1mol碳酸钠,将两个方程式相加得:2OH-+CO32-+3H+=HCO3-+2H2O,故B正确;
C.设NaOH和Na2CO3的物质的量都为1mol,则加入盐酸过量,先发生反应:OH-+H+→H2O,1mol氢氧化钠消耗1mol盐酸,再发生反应CO32-+2H+→CO2↑+H2O,将两个方程式相加得:OH-+CO32-+3H+=CO2↑+2H2O,故C正确;
D.设NaOH和Na2CO3的物质的量都为2mol,2mol氢氧化钠消耗2mol氢离子,2mol氢离子与2mol碳酸钠反应生成2mol碳酸氢根离子,离子方程式应为2OH-+2CO32-+4H+=2HCO3-+2H2O,故D错误;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握与量有关的离子反应、反应的先后顺序为解答的关键,侧重分析与应用能力的考查,注意物质的量关系,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 用氢氧化钠溶液清洗沾有油脂的试管 | |
| B. | 用稀硝酸清洗洁有银镜的试管 | |
| C. | 用水清洗沾有固体石蜡的试管 | |
| D. | 用乙醇清洗沾有苯酚的试管 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图装置可用于收集气体X并验证其某些化学性质,你认为不正确的是( )
如图装置可用于收集气体X并验证其某些化学性质,你认为不正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| ① | SO2 | 酸性高锰酸钾溶液 | 溶液褪色 | SO2有漂白性 |
| ② | NH3 | 滴有紫色石蕊的盐酸 | 溶液变蓝 | 氨水显碱性 |
| ③ | CO2 | 氯化钡溶液 | 溶液变浑浊 | 碳酸钡难溶于水 |
| ④ | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
| A. | ③④ | B. | ②④ | C. | ①② | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光照新制的氯水时,溶液的pH逐渐减小 | |
| B. | 可用浓氯水和氢氧化钠固体快速制取氨气 | |
| C. | 增大压强,有利于SO2与O2反应生成SO3 | |
| D. | 硅酸钠溶液在保存时不应用玻璃塞 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.
;实验室制备气体A的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑.查看答案和解析>>
科目:高中化学 来源: 题型:推断题

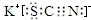 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②④⑤ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com