
【题目】随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
(1)如图为C及其氧化物的变化关系图,若①是通过O2与C反应实现的,测知生成14gCO时放出60kJ的热量,则其热化学方程式为 。

(2)把煤作为燃料可通过下列两种途径:
途径I:C(s)+O2(g)=CO2(g) △H1<0 ①
途径II:先制成水煤气:C(s)+H2O(g)=CO(g)+H2(g) △H2>0 ②
再燃烧水煤气:2CO(g)+O2(g)=2CO2(g) △H3<0 ③
2H2(g)+O2(g)=2H2O(g) △H4<0 ④
则途径I放出的热量 (填“大于”“等于”或“小于”)途径II放出的热量;△H1、△H2、△H3、△H4的数学关系式是 。
(3)甲醇(CH3OH)是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
方法二 CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
在25℃、101kPa下,1 克液态甲醇完全燃料放热25kJ,写出甲醇燃烧生成1molCO2的热化学方程式 。若将该反应设计成原电池反应,用稀H2SO4 作电解质,则其电极方程式分别为正极: 负极:
(4)金属钛冶炼过程中其中一步反应是将原料金红石转化:
TiO2(金红石)+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
已知:C(s)+O2(g)=CO2(g) △H= - 400kJ·mol―1
2CO(g)+O2(g)=2CO2(g) △H= - 560kJ·mol―1
TiO2(s)+2Cl2(g)=TiCl(s)+O2(g) △H=+140kJ·mol―1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= 。
(5)臭氧可用于净化空气、饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s) △H=―260kJ·mol―1
已知:2Ag2O(s)=4Ag(s)+O2(g) △H=+70kJ·mol―1
则O3转化为O2的热化学方程式为 。
【答案】
(1)2C(s)+O2( s ) = 2CO(s) △H=-240kJ/mol
(2)等于;△H1=△H2+![]() (△H3+△H4)
(△H3+△H4)
(3)CH4O(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-800kJ/mol;
3O2+ 12e- +12H+=6H2O;2CH3OH-12e-+2H2O=2CO2+12H+
(4)-100kJ/mol;(5)2O3(g)=3O2(g) △H=-310kJ/mol
【解析】
试题分析:(1)14gCO时放出60kJ的热量,1molCO的质量为28g,则放出120kJ热量,其热化学方程式为C(s)+![]() O2( s ) = CO(s) △H=-120kJ/mol,故答案为:C(s)+
O2( s ) = CO(s) △H=-120kJ/mol,故答案为:C(s)+![]() O2( s ) = CO(s) △H=-120kJ/mol;
O2( s ) = CO(s) △H=-120kJ/mol;
(2)由盖斯定律可知:若是一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同;根据盖斯定律,①=②+③×![]() +④×
+④×![]() 所以△H1=△H2+
所以△H1=△H2+![]() (△H3+△H4),故答案为:等于;△H1=△H2+
(△H3+△H4),故答案为:等于;△H1=△H2+![]() (△H3+△H4);
(△H3+△H4);
(3)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热25kJ,32g甲醇燃烧生成二氧化碳和液态水放出热量为800KJ;则表示甲醇燃烧热的热化学方程式为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=-800kJmol-1,将该反应设计成原电池反应,用稀H2SO4 作电解质,则其电极方程式分别为正极3O2+ 12e- +12H+=6H2O,负极2CH3OH-12e-+2H2O=2CO2+12H+,故答案为:CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-800kJmol-1,将该反应设计成原电池反应,用稀H2SO4 作电解质,则其电极方程式分别为正极3O2+ 12e- +12H+=6H2O,负极2CH3OH-12e-+2H2O=2CO2+12H+,故答案为:CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(l)△H=-800kJmol-1;3O2+ 12e- +12H+=6H2O;2CH3OH-12e-+2H2O=2CO2+12H+;
O2(g)=CO2(g)+2H2O(l)△H=-800kJmol-1;3O2+ 12e- +12H+=6H2O;2CH3OH-12e-+2H2O=2CO2+12H+;
(4)Ⅰ、C(s)+O2(g)═CO2(g)△H=-400kJmol-1;
Ⅱ、2CO(g)+O2(g)═2CO2(g)△H=-560kJmol-1,
Ⅲ、TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g)△H=+140kJmol-1,
盖斯定律计算Ⅰ×2-Ⅱ+Ⅲ得到:TiO2(s,金红石)+2C(s)+2Cl2(g)=TiCl4(s)+2CO(g)△H=-100kJ/mol,故答案为:-100kJ/mol;
(5)Ⅰ、6Ag(s)+O3(g)═3Ag2O(s),/span>△H=-260kJmol-1,
Ⅱ、2Ag2O(s)═4Ag(s)+O2(g),△H=+70kJmol-1,
根据盖斯定律可知Ⅰ×2+Ⅱ×3可得到,2O3(g)═3O2(g),
则反应热△H=(-260kJmol-1)×2+(+70kJmol-1)×3=-310kJ/mol,
故答案为:2O3(g)═3O2(g)△H=-310kJ/mol。


科目:高中化学 来源: 题型:
【题目】我国三峡工程所提供的清洁、廉价、可再生的水电,相当于每年燃烧 3000 万吨原煤的火力发电厂产生的电能,因此三峡工程有助于控制 ①温室效应 ②SO2的排放 ③白色污染 ④臭氧空洞( )
A.①② B.①②③ C.①②④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法不正确的是( )
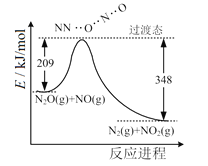
A.反应生成1mol N2时转移4 mole-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g) = N2(g)+NO2(g) △H=-139kJ/mol
D.断键吸收能量之和小于成键释放能量之和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)0.4 mol OH-的质量为 ,其中含有 个电子。
(2)质量比为16:7:6的三种气体SO2、CO、NO氧原子个数之比为 ;同条件下体积比为 。
(3)标准状况下,1体积水能溶解448体积HCI,所得溶液的密度为1.1 g/mL,该溶液的质量分数和物质的量的浓度分别是 、 。(保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种微生物燃料电池工作原理如图所示。下列有关该电池的说法中,正确的是

A.外电路电子从B极移向A极[来
B.溶液中H+由B极区移向A极区
C.电池工作一段时间后B极区溶液的pH减小[
D.A极电极反应式为:CH3COOH - 8e-+ 2H2O = 2CO2 + 8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铁矿主要成分是FeS2。某硫酸厂在进行黄铁矿成分测定时,取0.1000g样品在空气中充分燃烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为0.02000mol/L的K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液25.00ml。已知:
SO2+Fe3++2H2O=SO42-+Fe2++4H+ Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
(1)样品中FeS2的质量分数 (假设杂质不参加反应)。
(2)若燃烧6gFeS2产生的SO2全部转化为SO3气体时放出9.83kJ热量,产生的SO3与水全部化合生成H2SO4放出13.03kJ热量,写出SO3气体转化为H2SO4的热化学方程式 。
(3)煅烧10t上述黄铁矿,理论上产生SO2的体积(标准状况)为 L,制得98%的硫酸的质量为 t,SO2全部转化为SO3时放出的热量是 kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关组成生物体细胞的化学元素的叙述中,错误的是
A. 组成生物体的最基本元素是碳
B. H1N1病毒和桃树共有的元素是C、H、O、N、P等
C. 生物体内含有的元素都是生物体所必需的
D. Cu、Mn、Mo、B都是组成生物体的微量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C6H14的各种同分异构体中所含甲基数和它的一氯代物的数目分别是( )[
A.2个甲基,可能生成4种一氯代物
B.3个甲基,可能生成3种一氯代物
C.3个甲基,可能生成5种一氯代物
D.4个甲基,可能生成4种一氯代物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com