
白磷、红磷是磷的两种同素异形体,在空气中燃烧得到磷的氧化物,空气不足时生成P4O6,空气充足时生成P4O10。
1)已知298 K时白磷、红磷完全燃烧的热化学方程式分别为P4s,白磷)+5O2g)===P4O10s)
ΔH1=-2 983.2 kJ·mol-1
Ps,红磷)+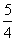 O2g)===
O2g)===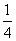 P4O10s)
P4O10s)
ΔH2=-738.5 kJ·mol-1
则该温度下白磷转化为红磷的热化学方程式为
____________________________________________________。
2)已知298 K时白磷不完全燃烧的热化学方程式为P4s,白磷)+3O2g)===P4O6s)
ΔH=-1 638 kJ·mol-1。在某密闭容器中加入62 g白磷和50.4 L氧气标准状况),控制条件使之恰好完全反应。则所得到的P4O10与P4O6的物质的量之比为________,反应过程中放出的热量为________。
解析 1)根据盖斯定律,由第一个反应-第二个反应×4,可得:P4s,白磷)===4Ps,红磷) ΔH=-2 983.2 kJ·mol-1--738.5 kJ·mol-1)×4=-29.2 kJ·mol-1。2)n白磷)=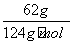 =0.5 mol,nO2)=
=0.5 mol,nO2)=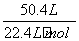 =2.25 mol,设得到的P4O10与P4O6的物质的量分别为x mol、y mol。则x+y=0.5,5x+3y=2.25,解得x=0.375,y=0.125。反应过程中放出的热量为2 983.2 kJ·mol-1×0.375 mol+1 638 kJ·mol-1×0.125 mol=1 323.45 kJ。
=2.25 mol,设得到的P4O10与P4O6的物质的量分别为x mol、y mol。则x+y=0.5,5x+3y=2.25,解得x=0.375,y=0.125。反应过程中放出的热量为2 983.2 kJ·mol-1×0.375 mol+1 638 kJ·mol-1×0.125 mol=1 323.45 kJ。
答案 1)P4s,白磷)===4Ps,红磷)
ΔH=-29.2 kJ·mol-1
2)3∶1 1 323.45 kJ


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
汽车尾气净化中的一个反应如下:
NO(g)+CO(g)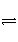

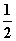 N2(g)+CO2(g)
N2(g)+CO2(g)
ΔH=-373.4 kJ·mol-1
在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是( )
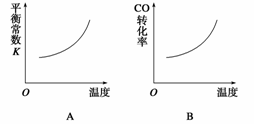
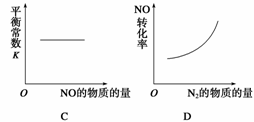
查看答案和解析>>
科目:高中化学 来源: 题型:
下列现象或应用不能用胶体的知识解释的是( )
A.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗
B.土壤表面积巨大且一般带负电,能吸收NH4+等营养离子,使土壤具有保肥能力
C.水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染
D.氯化铝溶液中加入碳酸钠溶液会出现白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中,微粒浓度关系正确的是
A.常温下,pH=6的由醋酸与醋酸钠组成的混合溶液中:c(Na+)>c(CH3COO-)
B. 将Cl2通入过量KOH溶液中:c(ClO-)+c(Cl-)=c(K+)
C. 0.1mol·L-1的Na2S溶液中:c(OH-)= c(H+)+c(HS-)+2 c(H2S)
D.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:
c(Cl-)> c(H+)> c(NH4+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应4A+2B3C,下列说法中正确的是 )。
A.某温度时,化学反应速率无论用A、B、C中任何物质表示,其数值都相同
B.其他条件不变时,降低温度,化学反应速率减小
C.其他条件不变时,增大压强,化学反应速率一定加快
D.若增大或减小A的物质的量,化学反应速率一定会发生明显的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是 )。
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素甲、乙、丙、丁在元素周期表的相对位置如表所示,其中甲的气态氢化物的水溶液呈碱性,则下列判断正确的是双选) )。
| 甲 | 乙 | |
| 丙 | 丁 |
A.甲位于元素周期表中第二周期ⅤA族
B.原子半径:甲>乙
C.单质的氧化性:丙>乙
D.气态氢化物的稳定性:丁>丙>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
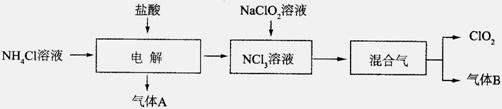 世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定。②气体B能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)电解时,发生反应的化学方程式为 。
实验室制备气体B的化学方程式为
为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;② 。
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为 。
(3)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30 min。
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知I2+2S2O32-=2I-+S4O62-)
①上述步骤3中滴定终点的现象是 ;
②根据上述步骤可计算出原ClO2溶液的浓度为 g /L(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知二氯化二硫(S2Cl2)的结构式为Cl—S—S—Cl,它易与水反应:2S2Cl2+2H2O===4HCl+SO2↑+3S↓。对该反应的说法正确的是(双选)( )
A.S2Cl2既作氧化剂又作还原剂
B.H2O作还原剂
C.每生成1 mol SO2转移3 mol电子
D.氧化产物与还原产物物质的量之比为3∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com