
【题目】500 ℃、20 MPa时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3的物质的量变化如下图所示,下列说法中正确的是( )
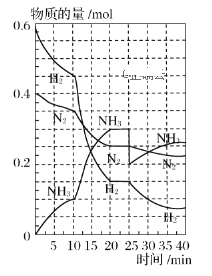
A.从反应开始到第一次平衡时,N2的平均反应速率为0.005 mol·L-1·min-1
B.平衡在10 min至20 min的变化,可能是因为增大了容器体积
C.25 min时,分离出了0.1 mol NH3
D.在25 min后平衡向正反应方向移动,新平衡中NH3的体积分数比原平衡的大
【答案】C
【解析】
A. 第一次平衡时,时间为20min,氮气的物质的量由0.4mol变为0.25mol,容器容积为2L,v(N2)=0.15mol÷(2L×20min)=0.00375mol/(Lmin),故A错误;
B. 由图象可知各组分物质的量变化加快,且10min时变化是连续的,20min达平衡时,△n(N2)=0.40.25=0.15mol,△n(H2)=0.6mol0.15mol=0.45mol,△n(NH3)=0.3mol,物质的量变化之比等于化学计量数之比,三种气体物质的速率增加倍数相同,说明10min可能改变的条件是使用催化剂,故B错误;
C. 25分钟,NH3的物质的量突然减少,由0.3mol变为了0.2mol,而H2、N2的物质的量不变,说明应是分离出NH3,故C正确;
D. 第25分钟,NH3的物质的量突然减少,而H2、N2的物质的量不变,说明应是分离出NH3,由于反应条件为恒容,与原平衡相比,容器内压强减小,则反应进行的程度减小,因此达到新平衡后NH3的体积分数比原平衡小,故D错误;
故选C。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】取一定量的CuCl2产品投入Na2CO3溶液中,充分反应生得到一种仅含四种元素的不溶性盐X,并产生气体CO2。设计如下实验探究X的组成和性质。已知各步反应所需试剂均过量,请回答:
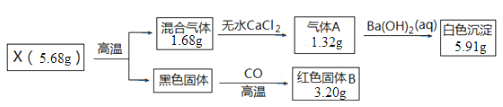
(1)混合气体的成分是______________;X的化学式为__________________。
(2)写出CuCl2与Na2CO3反应生成X的离子方程式______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。

查阅资料,平衡I:Cu(OH)2 + 4NH3 ![]() [Cu(NH3)4]2+ + 2OH-;
[Cu(NH3)4]2+ + 2OH-;
平衡II:Cu(OH)2 + 2OH- ![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/ mg·L-1 | 72 | ≤0.5 |
NH4+/ mg·L-1 | 2632 | ≤15 |
下列说法不正确的是
A. 废水中Cu2+处理的最佳pH约为9
B. b~c段:随pH升高,Cu(OH)2的量增加,平衡I正向移动,铜元素含量上升
C. c~d段:随pH升高,c(OH-)增加,平衡I逆向移动,铜元素含量下降
D. d点以后,随c(OH-)增加,铜元素含量可能上升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(化学一选修3:物质结构与性质)
含硼、氮、磷的化合物有许多重要用途,如:(CH3)3N、Cu3P、磷化硼等。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为________;基态Cu+的核外电子排布式为___________。
(2)化合物(CH3)3N分子中N原子杂化方式为________,该物质能溶于水的原因是______。
(3)PH3分子的键角小于NH3分子的原因是________________;亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式为______________________。
(4)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图所示:
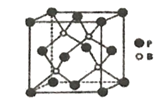
①在一个晶胞中原子的配位数为_______________。
②已知磷化硼晶体的密度为pg/cm3,阿伏加德罗常数为NA,则B-P键长为_________。
③磷化硼晶胞沿着体对角线方向的投影如图,请在答题卡上将表示B原子的圆圈涂黑_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.铅蓄电池的工作原理为:Pb+PbO2+2H2SO4=2PbSO4+2H2O,铅蓄电池在放电过程中,负极质量增加,正极质量也增加
B.金属铝的冶炼流程为:铝土矿![]() NaAlO2
NaAlO2![]() Al(OH)3
Al(OH)3![]() 无水AlCl3
无水AlCl3![]() Al
Al
C.铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀,但加热反应剧烈
D.一定条件下,使用催化剂能加快反应速率但不提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向 2.0 L恒容密闭容器中充入1.0 mol PCl5,反应PCl5(g)PCl3(g)+Cl2(g)经过一段时间后达到平衡。反应过程中测定的部分数据见下表。下列说法正确的是( )
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
A.反应在前 50 s 的平均速率v(PCl3)=0.0032 mol·L1·s1
B.该条件下,反应的平衡常数K=0.05
C.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L1,则反应的ΔH<0
D.其他条件相同时,向空的容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,此时 v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol·L1的HA溶液中逐滴加入0.1mol·L1的NaOH溶液,溶液中水所电离的c水(H+)随加入NaOH溶液体积的变化如图所示,下列说法正确的是
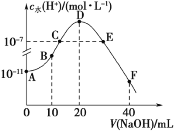
A.HA的电离常数Ka约为1×105
B.B点的溶液中粒子浓度满足关系:c(HA)>c(Na+)>c(A)
C.C、E两点因为对水的电离的抑制作用和促进作用相同,所以溶液均呈中性
D.F点的溶液呈碱性,粒子浓度满足关系c(OH)=c(HA)+c(A)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究Na2SO3 溶液和铬(VI)盐溶液的反应规律,某小组同学进行实验如下: 已知:![]() (橙色)+ H2O
(橙色)+ H2O![]() (黄色)+ 2H+
(黄色)+ 2H+
(1)配制溶液
序号 | 操作 | 现象 |
i | 配制饱和Na2SO3 溶液,测溶液的pH | pH 约为 9 |
ii | 配制0.05 mol·L1 的K2Cr2O7溶液,把溶液平均分成两份,向两份溶液中分别滴加浓硫酸和浓 KOH 溶液,得到pH=2 的溶液A 和 pH=8 的溶液B | pH=2的溶液A 呈橙色;pH=8的溶液 B 呈黄色 |
① 用化学用语表示饱和 Na2SO3 溶液 pH 约为 9 的原因:__。
(2)进行实验iii 和 iv:
序号 | 操作 | 现象 |
iii | 向 2 mL 溶液 A 中滴加 3 滴饱和 Na2SO3 溶液 | 溶液变绿色(含Cr3+) |
iv | 向 2 mL 溶液 B 中滴加 3 滴饱和 Na2SO3 溶液 | 溶液没有明显变化 |
② 用离子方程式解释 iii 中现象:__。
(3)继续进行实验v:
序号 | 操作 | 现象 |
v | 向 2 mL 饱和 Na2SO3 溶液中滴加 3 滴溶液A | 溶液变黄色 |
vi | 向 2 mL 蒸馏水中滴加 3 滴溶液A | 溶液变浅橙色 |
③ 实验 vi 的目的是__。
④ 用化学平衡移动原理解释 v 中现象:__。
⑤ 根据实验iii~v,可推测:Na2SO3 溶液和铬(VI)盐溶液的反应与溶液酸碱性有关,__。
⑥ 向实验 v 所得黄色溶液中滴加__,产生的现象证实了上述推测。
(4)继续探究溶液酸性增强对铬(VI)盐溶液氧化性的影响,该同学利用如图装置继续实验(已知电压大小反映了物质氧化还原性强弱的差异;物质氧化性与还原性强弱差异越大,电压越大)。
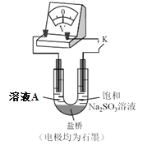
a.K 闭合时,电压为a。
b.向U 型管左侧溶液中滴加 3 滴浓硫酸后,电压增大了b。
⑦ 上述实验说明:__。
⑧ 有同学认为:随溶液酸性增强,溶液中O2 的氧化性增强也会使电压增大。利用如图装置选择合适试剂进行实验,结果表明O2 的存在不影响上述结论。该实验方案是__,测得电压增大了 d(d < b)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
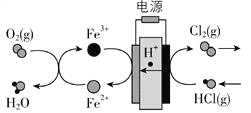
负极区发生的反应有_________![]() 写反应方程式
写反应方程式![]() 。电路中转移
。电路中转移![]() 电子,需消耗氧气__________
电子,需消耗氧气__________![]() 标准状况
标准状况![]() 。
。
![]() 电解法转化
电解法转化![]() 可实现
可实现![]() 资源化利用。电解
资源化利用。电解![]() 制HCOOH的原理示意图如下。
制HCOOH的原理示意图如下。
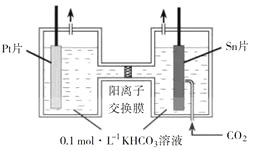
![]() 写出阴极
写出阴极![]() 还原为
还原为![]() 的电极反应式:________。
的电极反应式:________。
![]() 电解一段时间后,阳极区的
电解一段时间后,阳极区的![]() 溶液浓度降低,其原因是_____。
溶液浓度降低,其原因是_____。
![]() 可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接
可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接![]() 或
或![]() ,可交替得到
,可交替得到![]() 和
和![]() 。
。

![]() 制
制![]() 时,连接_______________。产生
时,连接_______________。产生![]() 的电极反应式是_________。
的电极反应式是_________。
![]() 改变开关连接方式,可得
改变开关连接方式,可得![]() 。
。
![]() 结合
结合![]() 和
和![]() 中电极3的电极反应式,说明电极3的作用:___________。
中电极3的电极反应式,说明电极3的作用:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com