

分析 (1)I.NO能和空气中氧气反应生成二氧化氮,但NO不溶于水且和水不反应,可以采用排水法或排其它不和NO反应的气体法收集;
Ⅱ.该装置相当于启普发生器,制取的气体反应物只要是块状固体和液体混合、不需要加热且生成的气体不能易溶于水即可;
Ⅲ.如果装置中气体压强过大会导致橡皮塞被喷出;
(2)为防止污染,在塞上瓶塞前只要Cu片和硝酸不接触即可.
解答 解:(1)Ⅰ、I.NO能和空气中氧气反应生成二氧化氮,但NO不溶于水且和水不反应,可以采用排水法或排其它不和NO反应的气体法收集,
①如果采用排水法收集,则广口瓶中要盛满水且导气管遵循“短进长出”原则,即NO从B管口通入,故答案为:广口瓶中盛满水,NO从B管通入;
②如果采用排气法收集,二氧化碳和NO不反应,可以用广口瓶盛满二氧化碳气体,NO从B管通入来收集NO,故答案为:广口瓶中盛满CO2气体,NO从B管通入;
Ⅱ、该装置相当于启普发生器,制取的气体反应物只要是块状固体和液体混合、不需要加热且生成的气体不能易溶于水即可,可以用此装置制取的气体有H2、CO2、H2S(写出其中任意两种即可),故答案为:H2、CO2、H2S(写出其中任意两种即可);
Ⅲ、如果装置中气体压强过大会导致橡皮塞被喷出,从而易产生安全事故,所以该同学做法错误,故答案为:否;
(2)为防止污染,在塞上瓶塞前只要Cu片和硝酸不接触即可,其具体做法为向试管中加入适量的硝酸后,将试管倾斜,以镊子夹取一小铜片于试管内壁上,小心塞紧橡皮塞后,再将试管慢慢竖起使铜片滑入底部,
故答案为:向试管中加入适量的硝酸后,将试管倾斜,以镊子夹取一小铜片于试管内壁上,小心塞紧橡皮塞后,再将试管慢慢竖起使铜片滑入底部.
点评 本题考查实验装置综合,涉及气体的制取、收集及实验基本操作,明确实验原理及操作规范性是解本题关键,注意化学用语的正确使用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液中加入过量氨水:Al3++4NH3.H2O=AlO2-+4NH4++2H2O | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-=CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2=2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 键长/(pm) | B-F | B-Cl | B-Br |
| 计算值 | 152 | 187 | 199 |
| 实测值 | 130 | 175 | 187 |

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中Ca2+数目减少 | B. | c(Ca2+)增大 | ||
| C. | 溶液中c(OH-)不变 | D. | 溶液中OH-数目不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验内容 | 实验目的 |
| A | 在食盐水中通入氟气置换出氯气 | 证明氟的非金属性强于氯 |
| B | 将滴有酚酞试液的氨水分成两份,并加热其中一份溶液 | 研究温度对弱电解质电离的影响 |
| C | 分别用玻璃棒蘸c(H+)相同的乙二酸和乙酸溶液,点在pH试纸上,并与标准比色卡对比 | 比较乙二酸和乙酸的酸性强弱 |
| D | 室温下,分别向体积、浓度均相同的Na2S2O3溶液中加入相同体积、不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
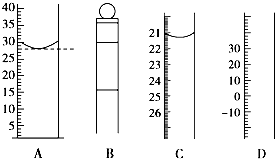 (1)图为常见仪器的部分结构(有的仪器被放大)
(1)图为常见仪器的部分结构(有的仪器被放大)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com