
”¾ĢāÄæ”æ3.20gNaOH¹ĢĢåĀ¶ÖĆÓŚæÕĘųÖŠŅ»¶ĪŹ±¼äŗ󣬲æ·Ö±äÖŹ£¬ÖŹĮæ±äĪŖ6.24g”£¼ÓĖ®Čܽā£¬½«ČÜŅŗ·ÖĪŖĮ½µČ·Ż£¬Ņ»·Ż¼ÓČė×ćĮæBa(OH)2ČÜŅŗ£¬³ä·Ö·“Ó¦ŗó¹żĀĖ”¢Ļ“µÓ”¢øÉŌļ£¬³ĘµĆ³ĮµķÖŹĮæĪŖ1.97g£¬ĮķŅ»·ŻÖšµĪµĪ¼Ó1mol”¤L1ŃĪĖį£¬Ęš³õĪŽĘųĢåÉś³É£¬ŃĪĖį¼ÓČė30mLŹ±£¬æŖŹ¼²śÉśĘųĢ壬×īÖÕ²śÉś±ź×¼×“æöĻĀµÄ224mLĘųĢå(¼ŁÉčĘųĢåČ«²æŅŻ³ö)”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ£Ø £©
A.µĪ¼ÓŃĪĖįŹ±£¬µŚŅ»²½·“Ó¦ĪŖCO32-+H+=HCO3-
B.±äÖŹŗó¹ĢĢå³É·ÖĪŖNa2CO3ŗĶNaHCO3
C.±äÖŹŗó¹ĢĢåÖŠNa2CO3µÄÖŹĮæm(Na2CO3)=1.06g
D.±äÖŹŗó¹ĢĢåÖŠNaOHµÄÖŹĮæ·ÖŹżw(NaOH)=25.6%
”¾“š°ø”æD
”¾½āĪö”æ
3.20gNaOH¹ĢĢåĀ¶ÖĆÓŚæÕĘųÖŠŅ»¶ĪŹ±¼äŗ󣬲æ·Ö±äÖŹ£¬ÖŹĮæ±äĪŖ6.24g£¬¼ÓĖ®Čܽā£¬½«ČÜŅŗ·ÖĪŖĮ½µČ·Ż£¬Ņ»·Ż¼ÓČė×ćĮæBa(OH)2ČÜŅŗ£¬Éś³É1.97g BaCO3³Įµķ£¬ĘäĪļÖŹµÄĮæĪŖ0.01mol£¬øł¾Ż·“Ó¦·½³ĢŹ½£ŗNa2CO3+Ba(OH)2=BaCO3”ż+2NaOH£¬n(Na2CO3)=0.01mol£¬ŌņŌ»ģŗĻĪļÖŠn(Na2CO3)=0.02mol£¬ĘäÖŹĮæĪŖm(Na2CO3)=2.12g£»ĮķŅ»·Ż¼ÓČė1mol”¤L1HCl£¬øÕæŖŹ¼ĪŽĘųĢå²śÉś£¬·¢ÉśµÄ·“Ó¦ĪŖ£ŗNaOH+HCl=NaCl+H2OŗĶNa2CO3+HCl=NaCl+NaHCO3£¬ĻūŗÄŃĪĖįµÄĢå»żĪŖ30mL£¬ĻūŗĵÄŃĪĖįµÄĪļÖŹµÄĮæĪŖ0.03mol£¬½Ó׿ÓČėŃĪĖį£¬·¢ÉśµÄ·“Ó¦ĪŖ£ŗNaHCO3+HCl=NaCl+CO2”ü+H2O£¬Éś³É0.01molCO2£¬ĻūŗĵÄŃĪĖįĪŖ0.01mol£¬×ܹ²ĻūŗÄ0.04molŃĪĖį£¬NaOHĻūŗÄ0.02molŃĪĖį£¬øł¾Ż·“Ó¦·½³ĢŹ½£ŗNaOH+HCl=NaCl+H2O£¬n(NaOH)=0.02mol£¬Ōņ¼ÓĖ®ČܽāŗóµÄ»ģŗĻĪļÖŠn(NaOH)=0.04mol£¬m(NaOH)=1.6g£¬ĖłŅŌĢ¼ĖįĒāÄʵÄÖŹĮæĪŖ£ŗm(NaHCO3)=(6.24-2.12-1.6)g=3.72g£¬ĖłŅŌ±äÖŹŗó¹ĢĢå³É·ÖĪŖNaOH”¢Na2CO3 ŗĶNaHCO3”£
A. NaOH¹ĢĢåĀ¶ÖĆÓŚæÕĘųÖŠŅ»¶ĪŹ±¼äŗ󣬲æ·Ö±äÖŹ£¬ĖłŅŌµĪ¼ÓŃĪĖįŹ±£¬µŚŅ»²½·“Ó¦ĪŖ£ŗOH-+H+=H2O-£¬A“ķĪó£»
B. øł¾ŻÉĻŹö·ÖĪö£¬±äÖŹŗó¹ĢĢå³É·ÖĪŖNaOH”¢Na2CO3 ŗĶNaHCO3£¬B“ķĪó£»
C. ¼ÓĖ®Čܽā£¬½«ČÜŅŗ·ÖĪŖĮ½µČ·Ż£¬Ņ»·Ż¼ÓČė×ćĮæBa(OH)2ČÜŅŗ£¬·¢Éś·“Ó¦ĪŖ£ŗNa2CO3+Ba(OH)2=BaCO3”ż+2NaOH£¬Éś³É1.97g BaCO3³Įµķ£¬ĘäĪļÖŹµÄĮæĪŖ0.01mol£¬Na2CO3µÄĪļÖŹµÄĮæĪŖ0.01mol£¬ĖłŅŌ¼ÓĖ®ČܽāŗóµÄ»ģŗĻČÜŅŗÖŠNa2CO3µÄĪļÖŹµÄĮæĪŖ0.02mol£¬±äÖŹŗó¹ĢĢåÖŠNa2CO3µÄÖŹĮæm(Na2CO3)=2.12g£¬C“ķĪó£»
D. ±äÖŹŗó¹ĢĢåÖŠNaOHµÄÖŹĮæĪŖ1.6g£¬NaOHµÄÖŹĮæ·ÖŹż£ŗ![]() £¬DÕżČ·£»¹Ź“š°øĪŖ£ŗD”£
£¬DÕżČ·£»¹Ź“š°øĪŖ£ŗD”£


 ŗčĶ¼Ķ¼Źéŗ®¼Ł×÷Ņµ¼ŁĘŚ×÷Ņµ¼ŖĮÖ“óѧ³ö°ęÉēĻµĮŠ“š°ø
ŗčĶ¼Ķ¼Źéŗ®¼Ł×÷Ņµ¼ŁĘŚ×÷Ņµ¼ŖĮÖ“óѧ³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æI£ŗĻÖÓŠŅŌĻĀ¼øÖÖĪļÖŹ¢ŁĮņĖį”¢¢Ś“×Ėį”¢¢ŪĒāŃõ»ÆÄĘ”¢¢ÜĀČ»Æļ§”¢¢Ż“×ĖįÄĘ”¢¢ŽŃĒĮņĖįĒāÄĘ”¢¢ß°±Ė®”£Ēė»Ų“šĻĀĮŠĪŹĢā:
£Ø1£©ŅŌÉĻĪļÖŹŹōÓŚČõµē½āÖŹµÄŹĒ______________£ØĢīŠņŗÅ£©£»
£Ø2£©³£ĪĀĻĀ¢ÜµÄČÜŅŗpH_____7£ØĢī”°>”±”°<”±»ņ”°=”±£©£¬ŌŅņ__________£ØÓĆĄė×Ó·½³ĢŹ½±ķŹ¾£©£»
£Ø3£©¢ŽµÄĖ®ČÜŅŗÖŠ³ŹĖįŠŌ£¬ŌŅņŹĒ__________________________£»
£Ø4£©³£ĪĀĻĀ,½«aL pH=11µÄNaOHČÜŅŗÓėbL pH=1µÄHNO3ČÜŅŗ»ģŗĻ(ŗöĀŌ»ģŗĻŗóČÜŅŗĢå»żµÄ±ä»Æ),ČōĖłµĆ»ģŗĻČÜŅŗµÄpH=2£¬Ōņa:b=________”£
£Ø5£©ŅŃÖŖ£ŗa£®³£ĪĀĻĀ£¬“×ĖįŗĶNH3H2OµÄµēĄėĘ½ŗā³£Źż¾łĪŖ1.74”Į10-5£»
b£®CH3COOH+NaHCO3ØTCH3COONa+CO2”ü+H2O
ŌņCH3COONH4ČÜŅŗ³Ź______ŠŌ£ØĢī”°Ėį”±”¢”°¼ī”±»ņ”°ÖŠ”±£¬ĻĀĶ¬£©£¬NH4HCO3ČÜŅŗ³Ź______ŠŌ”£
£Ø6£©¶ŌÓŚ“×ĖįČÜŅŗŗĶ“×ĖįÄĘČÜŅŗµÄĻĀĮŠĖµ·ØÕżČ·µÄŹĒ____________£»
A£®Ļ”ŹĶ“×ĖįČÜŅŗ£¬“×ĖįµÄµēĄė³Ģ¶ČŌö“󣬶ųĻ”ŹĶ“×ĖįÄĘČÜŅŗŌņ“×ĖįÄʵÄĖ®½ā³Ģ¶Č¼õŠ””£
B£®ÉżøßĪĀ¶ČæÉŅŌ“Ł½ų“×ĖįµēĄė£¬Ņ²æÉŅŌ“Ł½ų“×ĖįÄĘĖ®½ā”£
C£®“×ĖįŗĶ“×ĖįÄĘ»ģŗĻŅŗÖŠ£¬“×ĖįŅÖÖĘ“×ĖįÄʵÄĖ®½ā”¢“×ĖįÄĘŅ²ŅÖÖĘ“×ĖįµÄµēĄė”£
D£®³£ĪĀĻĀ£¬“×ĖįŗĶ“×ĖįÄʵČĢå»żµČÅØ¶Č»ģŗĻ£¬ČÜŅŗ³Ź¼īŠŌ”£
II£ŗ25”ꏱ£¬ĻņŹ¢ÓŠ50mL pH=3µÄHAČÜŅŗµÄ¾ųČČČŻĘ÷ÖŠ¼ÓČėpH=13µÄNaOHČÜŅŗ£¬¼ÓČėNaOHČÜŅŗµÄĢå»ż(V)ÓėĖłµĆ»ģŗĻČÜŅŗµÄĪĀ¶Č(T)µÄ¹ŲĻµČēĶ¼ĖłŹ¾”£
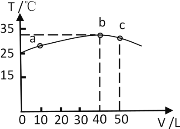
£Ø7£©ÓÉĶ¼æÉŅŌĶĘ³öHAČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖ_______________£¬25”ꏱ£¬pH=3µÄHAČÜŅŗµÄµēĄė¶ČĪŖ______________”£
£Ø8£©bµćČÜŅŗÖŠĄė×ÓÅضČÓɓ󵽊”µÄĖ³ŠņĪŖ_______________________”£
£Ø9£©¼ÓČėNaOHČÜŅŗÖĮČÜŅŗ³ŹÖŠŠŌŹ±³öĻÖŌŚĶ¼ÖŠµÄĪ»ÖĆ_________£ØĢī”°bµćĒ°”± ”°bµć”±»ņ”°bµćŗó”±£©£¬ČÜŅŗ³ŹÖŠŠŌŹ±£¬“ęŌŚ£ŗc(A£)______c(Na£«)£ØĢī”°>”±”°<”±»ņ”°=”±£©”£
III£ŗ£Ø10£©ŅŃÖŖ£ŗKsp[Al(OH)3]£½1”Į10£33£¬ pH£½7.1Ź±Mn(OH)2æŖŹ¼³Įµķ”£ŹŅĪĀĻĀ£¬³żČ„MnSO4ČÜŅŗÖŠµÄAl3£«(Ź¹ĘäÅØ¶ČŠ”ÓŚ1”Į10£6 mol”¤L£1)£¬Ščµ÷½ŚČÜŅŗpH·¶Ī§ĪŖ_______”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ²ŻĖįĪŖ¶žŌŖČõĖį£ŗ³£ĪĀĻĀ£¬ĻņijÅØ¶ČµÄ²ŻĖįČÜŅŗÖŠÖšµĪ¼ÓČėŅ»¶ØĮæÅØ¶ČµÄKOHČÜŅŗ£¬ĖłµĆČÜŅŗÖŠH2C2O4”¢HC2O4©”¢C2O42©ČżÖÖĪ¢Į£µÄĪļÖŹµÄĮæ·ÖŹż£Ø¦Ä£©ÓėČÜŅŗpHµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬ŌņĻĀĮŠĖµ·ØÖŠ²»ÕżČ·µÄŹĒ
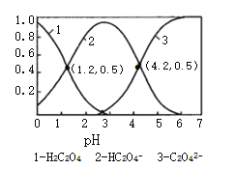
A. pH=1.2ČÜŅŗÖŠ£ŗc£ØK+£©+c£ØH+£©ØTc£ØOH©£©+c£ØH2C2O4£©
B. H2C2O4µÄµŚŅ»²½µēĄė£¬Ę½ŗā³£ŹżĪŖ10-1.2
C. ½«ĻąĶ¬ĪļÖŹµÄĮæKHC2O4ŗĶK2C2O4¹ĢĢåĶźČ«ČÜÓŚĖ®ĖłµĆ»ģŗĻŅŗµÄpHĪŖ4.2
D. ĻņpH=1.2µÄČÜŅŗÖŠ¼ÓKOHČÜŅŗ½«pHŌö“óÖĮ4.2µÄ¹ż³ĢÖŠĖ®µÄµēĄė³Ģ¶ČŌö“ó
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
A.ŹŅĪĀĻĀ£¬½«0.1mol”¤L”„1µÄHClČÜŅŗ¼ÓĖ®Ļ”ŹĶ10±¶£¬ĖłµĆČÜŅŗµÄpH=2
B.ŹŅĪĀĻĀ£¬pH=3µÄHClČÜŅŗŗĶpH=11µÄNaOHČÜŅŗÖŠ£¬c(Cl)=c(Na+)
C.0.1mol”¤L”„1µÄNaOHČÜŅŗÓėµČĢå»żCH3COOHČÜŅŗ»ģŗĻ£¬ČōĖłµĆČÜŅŗ³ŹÖŠŠŌ£¬Ōņc(CH3COOH)£¾0.1mol”¤L”„1
D.¼ÓČČÕōĮóĖ®Ź±£¬Ė®µÄĄė×Ó»ż³£ŹżKwŌö“ó£¬c(H+)Öš½„Ōö“ó£¬c(OH)Öš½„¼õŠ”
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĢģČ»ĘųæÉŅŌÖʱø“óĮæµÄ»Æ¹¤ŌĮĻ”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ÓÉĢģČ»ĘųÖʱøŗĻ³ÉĘų(COŗĶH2)£¬½ų¶ųæÉŗĻ³ÉH2C2O4”£
¢ŁÓū¼ÓæģH2C2O4ČÜŅŗŹ¹5mL0.01mol/LĖįŠŌKMnO4ČÜŅŗĶŹÉ«£¬æɲÉČ”µÄ“ėŹ©ÓŠ__________”¢_______________(Š“Į½µć)”£
¢ŚĻĀĮŠæÉŅŌÖ¤Ć÷H2C2O4ŹĒČõĖįµÄŹĒ___________”£
A.H2C2O4æÉŅŌ·Ö½āĪŖCO”¢CO2ŗĶH2O
B.³£ĪĀĻĀ£¬0.1mol/LNaHC2O4ČÜŅŗÖŠc(HC2O4-)+c(C2O42-)<0.lmol/L
C.0.1mol/LH2C2O4ČÜŅŗ25mLæÉŅŌĻūŗÄ0.1mol/LNaOHČÜŅŗ50mL
D.³£ĪĀĻĀ£¬0.05mol/LµÄH2C2O4ČÜŅŗpH”Ö4
£Ø2£©ŅŃÖŖ£ŗ¢ŁCO(g)+H2(g)![]() C(s)+H2O(g) ”÷H1=-130kJ/mol
C(s)+H2O(g) ”÷H1=-130kJ/mol
¢ŚCH4(g)![]() C(s)+2H2(g) ”÷H2=+76kJ/mol
C(s)+2H2(g) ”÷H2=+76kJ/mol
¢ŪCO2(g)+H2(g)![]() CO(g)+H20(g) ”÷H3=+41kJ/mol
CO(g)+H20(g) ”÷H3=+41kJ/mol
ŌņCH4(g)+CO2(g)![]() 2H2(g)+2CO(g) ”÷H=________”£
2H2(g)+2CO(g) ”÷H=________”£
£Ø3£©Ļņ2LČŻĘ÷ÖŠĶØČė3molCO2”¢3molCH4£¬ŌŚ²»Ķ¬ĪĀ¶ČĻĀ£¬ŅŌÄųŗĻ½šĪŖ“߻ƼĮ£¬·¢Éś·“Ó¦£ŗCH4(g)+CO2(g)![]() 2H2(g)+2CO(g)”£Ę½ŗāĢåĻµÖŠCH4ŗĶCO2µÄĢå»ż·ÖŹżČēĻĀĶ¼”£
2H2(g)+2CO(g)”£Ę½ŗāĢåĻµÖŠCH4ŗĶCO2µÄĢå»ż·ÖŹżČēĻĀĶ¼”£
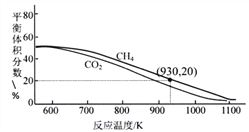
¢ŁøßĪĀĻĀøĆ·“Ó¦ÄÜ×Ō·¢½ųŠŠµÄŌŅņŹĒ______________£¬930KŹ±µÄĘ½ŗā³£ŹżK=___________(±£ĮōĮ½Ī»Š”Źż)”£
¢ŚĒė½āŹĶĶ¼ÖŠĒśĻßĖęĪĀ¶Č±ä»ÆµÄŌŅņ______________”£
¢ŪŌŚ700”«1100KÄŚ£¬Ķ¬ĪĀ¶ČĻĀĘ½ŗā×Ŗ»ÆĀŹ£ŗCO2________CH4(Ģī”°“óÓŚ”±”¢”° Š”ÓŚ”±»ņ”°µČÓŚ”±)£¬½įŗĻ£Ø2£©Ģį¹©µÄ·“Ó¦·ÖĪö£¬ĘäŌŅņæÉÄÜŹĒ______________”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅ»ÖÖČżŹŅĪ¢ÉśĪļČ¼ĮĻµē³ŲĪŪĖ®¾»»ÆĻµĶ³ŌĄķČēĻĀĶ¼ĖłŹ¾£¬Ķ¼ÖŠŗ¬·Ó·ĻĖ®ÖŠÓŠ»śĪļæÉÓĆC6H6O±ķŹ¾£¬×ó”¢ÖŠ”¢ÓŅŹŅ¼ä·Ö±šŅŌĄė×Ó½»»»Ä¤·Öøō”£ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
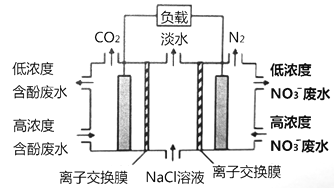
A. ×ó³ŲµÄpHÖµ½µµĶ
B. ÓŅ±ßĪŖŅõĄė×Ó½»»»Ä¤
C. ÓŅ³Ųµē¼«µÄ·“Ó¦Ź½£ŗ2NO3-+10e-+12H+= N2”ü+ 6H2O
D. µ±ĻūŗÄ0.1molC6H6O£¬ŌŚ±ź×¼×“æöĻĀ½«²śÉś0.28molµŖĘų
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æøł¾ŻĖłŃ§ŌĄķ£¬Ķź³ÉĻĀĮŠø÷Ģā
(1)“Ó»Æѧ¼üµÄ½Ē¶Č·ÖĪö£¬»Æѧ·“Ó¦µÄ¹ż³Ģ¾ĶŹĒ¾É¼ü¶ĻĮŃŗĶŠĀ¼üµÄŠĪ³É¹ż³Ģ”£ŅŃÖŖ·“Ó¦£ŗN2(g)+ 3H2(g)![]() 2NH3(g) ”÷H=©93kJ/mol”£ŹŌøł¾Ż±ķÖŠĖłĮŠ¼üÄÜŹż¾Ż£¬¼ĘĖća µÄŹżÖµĪŖ____kJ/mol”£
2NH3(g) ”÷H=©93kJ/mol”£ŹŌøł¾Ż±ķÖŠĖłĮŠ¼üÄÜŹż¾Ż£¬¼ĘĖća µÄŹżÖµĪŖ____kJ/mol”£
»Æѧ¼ü | H©H | N©H | N”ŌN |
¼üÄÜ/(kJ/mol) | 436 | a | 945 |
(2)25 ”ꏱ£¬½«a mol/L°±Ė®Óė0.01 mol/LŃĪĖįµČĢå»ż»ģŗĻ£¬·“Ó¦Ę½ŗāŹ±ČÜŅŗÖŠc(NH4+)=c(Cl-)£¬ŌņČÜŅŗĻŌ________(Ģī”°Ėį”±”°¼ī”±»ņ”°ÖŠ”±)ŠŌ”£ÓĆŗ¬aµÄ“śŹżŹ½±ķŹ¾NH3”¤H2OµÄµēĄė³£ŹżKb£½________”£
(3)Ļņŗ¬ÓŠBaSO4µÄ±„ŗĶČÜŅŗÖŠ
¢Ł¼ÓČėNa2SO4ČÜŅŗ,Ōņc(Ba2+)__________(Ģī”°±ä“ó”±”¢”°±äŠ””±»ņ”°²»±ä”±£¬ĻĀĶ¬)”£
¢ŚČōøļÓøü¶ąµÄ¹ĢĢåBaSO4£¬Ōņc(Ba2+)½«__________”£
(4)ÄæĒ°ŅŃæŖ·¢³öÓƵē½ā·ØÖĘČ”ClO2µÄŠĀ¹¤ŅÕ”£

¢ŁĶ¼ÖŠÓĆŹÆÄ«×öµē¼«£¬ŌŚŅ»¶ØĢõ¼žĻĀµē½ā±„ŗĶŹ³ŃĪĖ®ÖĘČ”ClO2”£ŌņŃō¼«²śÉśClO2µÄµē¼«·“Ó¦Ź½ĪŖ___________”£
¢Śµē½āŅ»¶ĪŹ±¼ä£¬µ±Ņõ¼«²śÉśµÄĘųĢåĢå»żĪŖ112 mL (±ź×¼×“æö)Ź±£¬Ķ£Ö¹µē½ā”£ĶعżŃōĄė×Ó½»»»Ä¤µÄŃōĄė×ÓµÄĪļÖŹµÄĮæĪŖ________mol”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČēĶ¼ĪŖĶŠæŌµē³ŲµÄŹ¾ŅāĶ¼£¬ĻĀĮŠĖµ·Ø“ķĪóµÄŹĒ
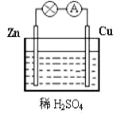
A. Ņ»¶ĪŹ±¼äŗ󣬊æʬ֚½„Čܽā£¬ÖŹĮæ¼õŠ”
B. øĆ×°ÖĆÄܽ«µēÄÜ×Ŗ»ÆĪŖ»ÆѧÄÜ
C. ½«Ķʬ»»³ÉŹÆÄ«°ō£¬µĘÅŻĮĮ¶Č²»±ä
D. Ķ²»²ĪÓėŃõ»Æ»¹Ō·“Ó¦£¬Ö»Ęšµ¼µē×÷ÓĆ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖ£ŗH2(g)£«F2(g)===2HF(g) µÄÄÜĮæ±ä»ÆČēĶ¼ĖłŹ¾£¬ĻĀĮŠÓŠ¹ŲŠšŹöÖŠÕżČ·µÄŹĒ

A£®·ś»ÆĒāĘųĢå·Ö½āÉś³ÉĒāĘųŗĶ·śĘųµÄ·“Ó¦ŹĒ·ÅČČ·“Ó¦
B£®1 mol H2Óė1 mol F2·“Ӧɜ³É2 molŅŗĢ¬HF·Å³öµÄČČĮæŠ”ÓŚ270 kJ
C£®ŌŚĻąĶ¬Ģõ¼žĻĀ£¬1 mol H2Óė1 mol F2µÄÄÜĮæ×ÜŗĶ“óÓŚ2 mol HFĘųĢåµÄÄÜĮæ
D£®¶ĻĮŃ1 mol H”ŖH¼üŗĶ1 mol F”ŖF ¼üĪüŹÕµÄÄÜĮæ“óÓŚŠĪ³É2 mol H”ŖF¼ü·Å³öµÄÄÜĮæ
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com