
分析 (1)根据N2H4在氧气中完全燃烧生成氮气和H2O,写出其相应的化学方程式;
(2)燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应,正极为氧气得电子发生还原反应;
(3)根据转移电子计算消耗的氧气,根据氧气计算需要空气的体积.
解答 解:(1))因为N2H4在氧气中完全燃烧生成氮气和H2O,所以其化学反应方程式为:N2H4+O2=N2+2H2O,
故答案为:N2H4+O2=N2+2H2O;
(2)燃料电池中,负极上投放的是燃料,负极上燃料失电子发生氧化反应,在碱性环境下的反应式为:N2H4+4OH--4e-=4H2O+N2↑,正极为氧气得电子发生还原反应,在碱性环境下的反应式为:O2+2H2O+4e-=4OH-;
故答案为:O2+2H2O+4e-=4OH-;N2H4+4OH--4e-=4H2O+N2↑;
(3)若有4mol电子在电路中经过,则根据正极反应O2+2H2O+4e-=4OH-,有1mol氧气消耗,则需要空气的体积=$\frac{1mol}{20%}$×22.4L/mol=112L,故答案为:112.
点评 本题考查了方程式的书写、燃料电池原理,明确燃料电池的正负极的反应即可解答,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物不一定是共价化合物 | |
| B. | 全部由非金属元素组成的化合物一定是共价化合物 | |
| C. | 由共价键形成的分子一定是共价化合物 | |
| D. | 硫酸分子中有H+和SO42-两种离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
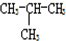
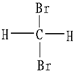 和
和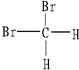
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素与非金属元素能形成共价化合物 | |
| B. | 只有在原子中,质子数与核外电子数相等 | |
| C. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| D. | 氧和臭氧互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和甲醇 | B. | 邻羟基苯甲醛与对羟基苯甲醛 | ||
| C. | 对羟基苯甲酸与邻羟基苯甲酸 | D. | H2O和H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
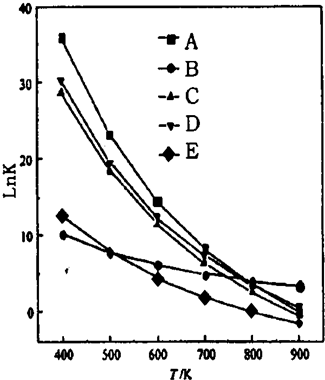 CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低.
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
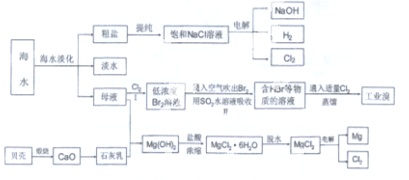
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把电能转变为化学能的装置 | |
| B. | 活泼金属做正极,不活泼金属或非金属做负极 | |
| C. | 外电路中电子从负极流向正极 | |
| D. | 正极发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com