
分析 Ⅰ.A.Cu、Mg、Al都能和稀硝酸反应;
B.澄清石灰水试液和SO2、CO2反应都生成白色沉淀;
C.CaCl2和NaCl都易溶于水;
D.胶体具有丁达尔效应;
E.FeSO4易发生水解反应和氧化反应;
Ⅱ(一) 该反应中-2价硫化合价升高为+4价,生成16mol二氧化硫,转移100mol电子;
(二)(1)过滤时需要的玻璃仪器有漏斗、烧杯和玻璃棒;
(2)滤液先氧化然后加入过量NaOH溶液,得到的固体是氢氧化铁,灼烧沉淀得到的固体A是氧化铁,其质量为16g,先计算氧化铁中铁元素质量,再计算该样品中CuFeS2的质量分数.
(3)FeO与硫酸反应生成硫酸亚铁,再滴入酸性高锰酸钾溶液,溶液紫色褪去,可以检验FeO存在.
解答 解:Ⅰ.A.Cu、Mg、Al都能和稀硝酸反应,应该用稀盐酸或稀硫酸除去Mg、Al,故A错误;
B.澄清石灰水试液和SO2、CO2反应都生成白色沉淀,应该用品红溶于鉴别二者,故B错误;
C.CaCl2和NaCl都易溶于水,不能采用溶解过滤方法分离,故C错误;
D.胶体具有丁达尔效应,氢氧化铁胶体具有丁达尔效应,氯化铁溶液没有丁达尔效应,故D正确;
E.FeSO4易发生水解反应和氧化反应,所以FeSO4溶液存放在加有少量铁粉的试剂瓶中防止亚铁离子被氧化,故D正确;
故选DE;
Ⅱ(一)反应中-2价硫化合价升高为+4价,生成16mol二氧化硫,转移100mol电子,则生成1.6mol二氧化硫转移10mol电子,故答案为:10;
(二)(1)过滤时需要的玻璃仪器有漏斗、烧杯和玻璃棒,故答案为:漏斗、玻璃棒和烧杯;
(2)滤液先氧化然后加入过量NaOH溶液,得到的固体是氢氧化铁,灼烧沉淀得到的固体A是氧化铁,其质量为16g,氧化铁中Fe元素质量=$\frac{16g}{160g/mol}×2×56g/mol$=11.2g,
CuFeS2中Fe元素质量分数=$\frac{56}{184}$,CuFeS2的质量=$\frac{11.2g}{\frac{56}{184}}$=36.8g,
该样品中CuFeS2的质量分数=$\frac{36.8g}{40g}$×100%=92%,
故答案为:92%;
(3)FeO与硫酸反应生成硫酸亚铁,亚铁离子具有还原性,再滴入酸性高锰酸钾溶液,溶液紫色褪去,可以检验FeO存在,故选:A,E.
点评 本题考查物质分离和提纯、化学实验方案评价,为高频考点,涉及物质分离和提纯、计算、实验基本操作等知识点,明确实验原理及物质性质差异性是解本题关键,易错点是(二)中(2)的计算,题目难度中等.


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:解答题
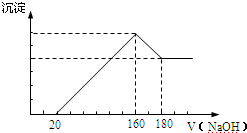
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
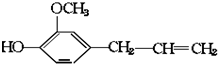 其可能具有的性质是( )
其可能具有的性质是( )| A. | ②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ①②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO+H2O═Ca(OH)2 | B. | CO2+C $\frac{\underline{\;高温\;}}{\;}$ 2CO | ||
| C. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O | D. | NaOH+HCl═NaCl+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的氧化物均能和水反应 | |
| B. | X与Y形成的化合物可能是离子化合物,也可能是共价化合物 | |
| C. | X的原子半径一定大于Y的原子半径 | |
| D. | X与Y的简单离子不可能具有相同的电子层结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
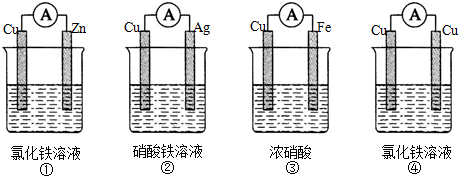
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 | |
| B. | SO2是硫在空气中不完全燃烧的产物,SO3是硫在空气中完全燃烧的产物 | |
| C. | 大气中SO2的主要来源是汽车排出的尾气 | |
| D. | SO2具有漂白性,因而可以使石蕊试液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
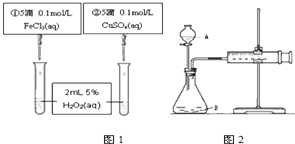
| A. | 图1实验可通过观察产生气泡快慢来比较反应速率的大小 | |
| B. | 若图1所示实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好 | |
| C. | 用图2装置可测定反应产生的气体体积 | |
| D. | 为检查图2装置的气密性,可关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
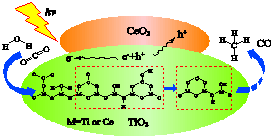 2016年3月新疆理化技术研究所首先发现:在光、碱性CeO2修饰TiO2的复合纳米材料的催化作用下,二氧化碳和水可转化为甲烷和一氧化碳.下列说法不正确的是( )
2016年3月新疆理化技术研究所首先发现:在光、碱性CeO2修饰TiO2的复合纳米材料的催化作用下,二氧化碳和水可转化为甲烷和一氧化碳.下列说法不正确的是( )| A. | 此反应可将光能转化为化学能 | |
| B. | CO2和CH4均含极性共价键 | |
| C. | 产物可能还有O2 | |
| D. | CO2溶于水呈酸性的原因:CO2+H2O?H2CO3H2CO3?2H++CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com