
【题目】某同学帮助水质检测站配制480 mL 0.5 mol·L-1 NaOH溶液以备使用。
Ⅰ.该同学应称取NaOH固体________g。容量瓶的使用之前需要_____。溶液的配置过程操作步骤如图2所示,则图1操作应在图2中的___(填选项字母)之间。操作②中液体转移到容量瓶要注意__________。图⑤操作的名称是________,进行该操作时要注意_________________。
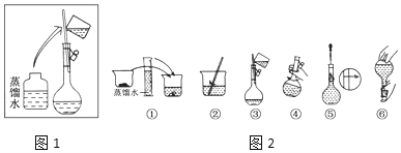
A.②与③ B.①与② C.④与⑤ D.⑤与⑥
Ⅱ.实验室用 63%的浓 HNO3 (其密度为 1.4 g·mL -1)配制 240 mL 0.50 mol·L-1 稀 HNO3,若实验仪器有:
A.10 mL 量筒 B.50 mL 量筒 C.托盘天平 D.玻璃棒 E.100 mL 容量瓶
F.250 mL 容量瓶 G.500 mL 容量瓶 H.胶头滴管 I.200mL 烧杯
(1)此浓硝酸的物质的量浓度为_____mol·L -1。
(2)应量取 63%的浓硝酸_____mL,应选用_____(填仪器的字母编号)。
(3)实验时还需选用的仪器有 D、I、______(填序号)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)______。
①量取浓硝酸的量筒用蒸馏水洗涤 2~3 次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
【答案】10.0 查漏 C 冷却到室温 定容 液面距刻度线1~2cm时改用胶头滴管滴加至凹液面最低处与刻度线相切 14.0 8.9 A F、H ①③
【解析】
(1) )配制480 mL 0.5 mol·L-1 NaOH溶液,应选择500mL容量瓶,需要溶质质量m=0.5 mol·L-1 ![]()
![]() 10-3
10-3![]() 40g/mol=10.0g; 容量瓶带有活塞,为防止漏液,使用前需要检查是否漏水; 配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀,图示操作为洗涤、摇动后,用胶头滴管定容前,所以C选项是正确的; 操作②中液体转移到容量瓶前要注意把液体冷却。 图⑤操作的名称是定容,进行定容操作时要注意液面离容量瓶刻度线1-2cm时,改用胶头滴管加水至凹液面与容量瓶刻度线相切。答案:10.0、检查是否漏水(检漏)、 C、冷却到室温、定容 、液面离容量瓶刻度线1-2cm时,改用胶头滴管加水至凹液面与容量瓶刻度线相切 。
40g/mol=10.0g; 容量瓶带有活塞,为防止漏液,使用前需要检查是否漏水; 配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀,图示操作为洗涤、摇动后,用胶头滴管定容前,所以C选项是正确的; 操作②中液体转移到容量瓶前要注意把液体冷却。 图⑤操作的名称是定容,进行定容操作时要注意液面离容量瓶刻度线1-2cm时,改用胶头滴管加水至凹液面与容量瓶刻度线相切。答案:10.0、检查是否漏水(检漏)、 C、冷却到室温、定容 、液面离容量瓶刻度线1-2cm时,改用胶头滴管加水至凹液面与容量瓶刻度线相切 。
Ⅱ(1)浓硝酸物质的量浓度c=100![]() =1000
=1000![]() 1.4
1.4![]() 14.0mol/L;
14.0mol/L;
(2)由于无240mL容量瓶,故应选用250mL容量瓶,配制出250mL溶液,设需要的浓硝酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀:14.0mol/L×VmL=250mL×0.50mol/L,解得V=8.9mL;根据“大而近”的原则,根据需要量取的浓硝酸的体积为8.9mL,故应选择10mL量筒,答案为A;
(3)根据配制步骤是计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器有10mL量筒、烧杯、玻璃棒、250mL容量瓶和胶头滴管,故还需要的仪器有250mL容量瓶和胶头滴管,故答案为F、H;
(4)①量取浓硝酸的量筒用蒸馏水洗涤2-3次,并把洗涤液转入容量瓶,会导致溶质的量偏多,则浓度偏高,故①正确;②容量瓶使用时未干燥,对浓度无影响,故②错误;③溶解后未经冷却就移液,则冷却后溶液体积偏小,浓度偏高,故③正确;④定容时不小心有少量蒸馏水滴到瓶外,会导致溶质的损失,则浓度偏低,故④错误;⑤定容后经振荡、摇匀、静置,发现液面低于刻度线是正常的,再加蒸馏水补至刻度线会导致浓度偏低,故⑤错误;故答案为①③。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 乙醇和汽油(从石油中提炼)都是可再生能源,应大力推广“乙醇汽油”
B. 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应
C. 氢能具有的优点是原料来源广、热值高、储存方便、制备工艺廉价易行
D. 氢能是一次能源(从自然界中以现成形式提供的能源为一次能源)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组设计实验制备供氧剂氢化钙(CaH2),实验装置如下图所示。
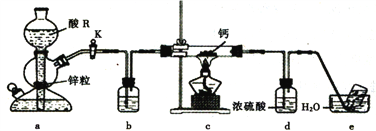
已知:①钙能与H2O、HCl、O2等反应;②氢化钙遇水剧烈反应。下列说法正确的是
A. 相同条件下,粗锌(含少量铜)比纯锌反应速率慢
B. 酸R为浓盐酸,装置b中盛装浓硫酸
C. 实验时先点燃酒精灯,后打开活塞K
D. 装置d的作用是防止水蒸气进入硬质玻璃管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有以下反应方程式:
A.CuO+H2![]() Cu+H2O
Cu+H2O
B.2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
C.Cl2+2NaOH==NaCl+NaClO+H2O
D.2FeBr2+3Cl2=2FeCl3+2Br2
E.MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
F.KClO3+6HCl(浓)=KC1+3H2O+3Cl2↑
G.HgS+O2=Hg+SO2
I.按要求将上述化学方程式序号填入相应空格内:
(1)一种单质使一种化合物中的一种元素被还原____________________;
(2)同一种物质中,同种元素间发生氧化还原反应________________;
(3)所有元素均参加氧化还原反应的是____________________________。
II.已知方程式F:KClO3+6HCI(浓)=KCl+3H2O+3Cl2↑。
(1)请用双线桥法标出电子转移的方向和数目_______________________;
(2)标准状况下当有33.6L的氯气放出时,转移电子的数目是_________________________;
(3)上述反应中氧化产物和还原产物的质量比为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为![]() 的F有机物广泛用于香精的调香剂.
的F有机物广泛用于香精的调香剂.
已知: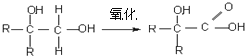
为了合成该物,某实验室的科技人员设计了下列合成路线:
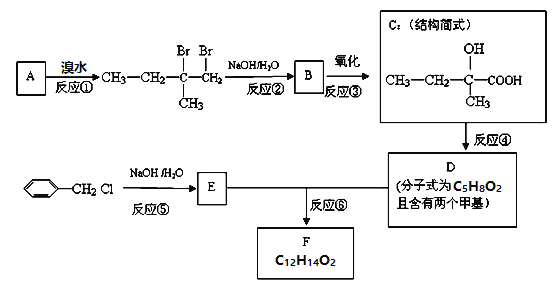
试回答下列问题:
(1)C物质的官能团名称______ , E物质的结构简式______.
(2)A物质的名称__________,1molA与氯气加成后再与氯气取代,整个过程最多需氯气______mol.
(3)上述合成路线中属于取代反应的是______ ![]() 填编号
填编号![]() .
.
(4)反应②的化学方程式为______ .
(5)D物质可发生聚合反应,写出D加聚反应产物的结构简式________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氟的卤素互化物通常作氟化剂,使金属氧化物转化为氟化物,如2Co3O4+6C1F3= 6CoF3+3C12+4X。下列有关该反应的说法,正确的是
A. X与O3互为同位素 B. ClF3中氯元素为-3价
C. Co3O4在反应中作氧化剂 D. lmol Co3O4参加反应转移9 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①H+(aq)+OH﹣(aq)═H2O(l);△H1;②2SO2(g)+O2(g)2SO3(g);△H2 . 其他条件不变时,改变反应物的量,则下列判断正确的是( )
A.△H1 , △H2都不变
B.△H1 , △H2都增大
C.△H1 , △H2都减小
D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某潜艇上的核反应堆内使用了液体铝钠合金作载热介质,下列关于Al、Na原子结构的分析中正确的是
A. 原子半径:Al>Na B. 第一电离能:Al<Na
C. 基态原子未成对电子数:Na = Al D. 硬度:Na>Al
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com