
 )分子的一氯代物有2种.
)分子的一氯代物有2种. 系统命名为3-甲基-2-乙基-1-丁烯
系统命名为3-甲基-2-乙基-1-丁烯 请写出其单体结构:
请写出其单体结构: 、
、 、
、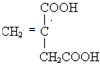 .
. 分析 (1)氢原子的种类等于一氯代物的种类;
(2)乙二醇与氧气发生催化氧化生成OHCCHO;
(3)从距离双键近的一端命名;
(4)根据加聚产物判断单体时,当有多条单键相连时,隔一条断一条;当遇到碳碳双键时,应考虑单体为炔烃或二烯烃.
解答 解:(1)分子中含4个CH,6个CH2,共2种位置的H,所以该物质的一氯代物有2种,故答案为:2;
(2)乙二醇与氧气发生催化氧化生成OHCCHO和水,化学方程式:HOCH2CH2OH+O2$\stackrel{催化剂}{→}$OHCCHO+2H2O,故答案为:HOCH2CH2OH+O2$\stackrel{催化剂}{→}$OHCCHO+2H2O;
(3)含双键的最长碳链为主链,从距离双键近的一端命名,名称为:3-甲基-2-乙基-1-丁烯,故答案为:3-甲基-2-乙基-1-丁烯;
(4)根据加聚产物判断单体时,当有多条单键相连时,隔一条断一条,故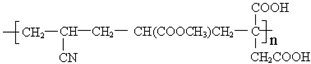 中应这样断键:
中应这样断键: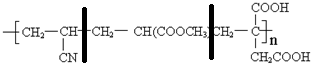 ,将所得的半键复原为双键,故单体为
,将所得的半键复原为双键,故单体为 、
、 、
、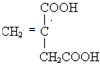 ,
,
故答案为: 、
、 、
、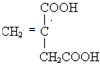 .
.
点评 本题考查了等效氢原子的判断、烷烃的命名、单体的判断和化学方程式的书写,难度不大,应注意的是由加聚产物判断单体的方法:当有多条单键相连时,隔一条断一条;当遇到碳碳双键时,应考虑单体为炔烃或二烯烃.


科目:高中化学 来源: 题型:解答题
 、
、 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+,Cu2+,OH-,HCO3- | B. | Mg2+,NH4+,Br-,SO42- | ||
| C. | Ca2+,Fe3+,Cl-,CO32- | D. | Fe2+,H+,ClO-,SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醛和丙烯醛( )是同系物 )是同系物 | |
| B. | HOCH2COOH的缩聚物是 | |
| C. | 已知甲醛分子中各原子共平面,则丙烯醛所有原子一定共平面 | |
| D. | 结构为…CH=CH-CH=CH-CH=CH-CH=CH…的高分子的单质是1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据酸分子中含有H原子个数将酸分为一元酸、二元酸 | |
| B. | 根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 根据元素原子最外层电子数的多少将元素分为金属元素和非金属元素 | |
| D. | 根据分散系的稳定性大小将混合物分为胶体、溶液和浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制5%食盐溶液时,将称量的食盐放入烧杯中,加计量的水搅拌溶解 | |
| B. | 硫酸铜晶体水含量测定时,需用小火缓慢加热,防止晶体飞溅 | |
| C. | 配制25%H2SO4时,可以将50%的H2SO4溶液与水等质量混合 | |
| D. | 配制0.1mol•L-1H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com