
【题目】某研究小组在实验室以含铁的铜屑为原料制备Cu(NO3)2·H2O晶体,并进一步探究用SOCl2制备少量无水Cu(NO3)2。设计的合成路线如下:

已知:Cu(NO3)2·3H2O ![]() Cu(NO3)2·Cu(OH)2
Cu(NO3)2·Cu(OH)2 ![]() CuO
CuO
SOCl2熔点―105℃、沸点76℃、遇水剧烈水解生成两种酸性气体。
请回答:
(1)第②步调pH适合的物质是_________(填化学式)。
(2)第③步包括蒸发浓缩、冷却结晶、抽滤等步骤,其中蒸发浓缩的具体操作是_____________。为得到较大颗粒的Cu(NO3)2·3H2O晶体,可采用的方法是___________(填一种)。
(3)第④步中发生反应的化学方程式是_______________________。
(4)第④步,某同学设计的实验装置示意图(夹持及控温装置省略,如图)有一处不合理,请提出改进方案并说明理由___________________。

装置改进后,向仪器A中缓慢滴加SOCl2时,需打开活塞______(填“a”、“b”或“a和b”)。
(5)为测定无水Cu(NO3)2产品的纯度,可用分光光度法。
已知:4NH3·H2O + Cu2+ == Cu(NH3)42+ + 4H2O;Cu(NH3)42+ 对特定波长光的吸收程度(用吸光度A表示)与Cu2+ 在一定浓度范围内成正比。现测得Cu(NH3)42+的吸光度A与Cu2+ 标准溶液浓度关系如图所示:

准确称取0.3150g无水Cu(NO3)2,用蒸馏水溶解并定容至100 mL,准确移取该溶液10.00mL,加过量NH3·H2O,再用蒸馏水定容至100 mL,测得溶液吸光度A=0.620,则无水Cu(NO3)2产品的纯度是_________(以质量分数表示)。
【答案】 CuO或Cu(OH)2或Cu2(OH)2CO3 将溶液转移至蒸发皿中,控制温度(不高于170℃,防止硝酸铜水解),加热至溶液表面形成一层晶膜 减慢冷却结晶的速度或冷却后静置较长时间 Cu(NO3)23H2O+3SOC12=Cu(NO3)2+3SO2↑+6HCl↑ 在AB之间增加干燥装置,防止B中的水蒸气进入A中 b 92.5%
【解析】为提高铜的浸取率,所用硝酸必然是过量的,此时铁也溶解转化为硝酸铁,调pH的目的是除去铁离子。然后蒸发浓缩、降温结晶得到硝酸铜晶体,最后在SOCl2的保护下脱去结晶水得到无水硝酸铜,据此解答。
(1)调节pH促进铁离子水解沉淀铁离子,不引入新杂质,同时不能沉淀铜离子,因此第②步调pH适合的物质是CuO或Cu(OH)2或Cu2(OH)2CO3;
(2)根据题意,温度不能高于170℃,否则Cu(NO3)23H2O变质,故蒸发浓缩应将溶液转移至蒸发皿中,控制温度(不高于170℃),加热至溶液表面形成一层晶膜减慢冷却结晶的速度,可得到较大颗粒的Cu(NO3)23H2O晶体;
(3)根据以上分析可知第④步中发生反应的化学方程式是Cu(NO3)23H2O+3SOC12=Cu(NO3)2+3SO2↑+6HCl↑;
(4)第④步,某同学设计的实验装置有一处不合理,根据装置图可知应该是氢氧化钠溶液中的水蒸气可以进入A中影响A中的硝酸铜晶体脱水反应。改进的方法是在AB之间增加干燥装置,理由是防止B中的水蒸气进入A中;装置改进后,向仪器A中缓慢滴加SOCl2时,需打开活塞b。
(5)由图像可知,A=0.620时,对应的溶液中c(Cu2+)=1.55×10-3mol/L,则n[Cu(NO3)2]=100mL/10mL×0.1L×1.55×10-3mol/L=1.55×10-3mol,则无水Cu(NO3)2产品的纯度是1.55×10-3×188/0.3150×100%=92.5%。


科目:高中化学 来源: 题型:
【题目】非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:

请回答下列问题:
(1)非诺洛芬中的含氧官能团为________________(填名称)。
(2)反应①中加入的试剂X的分子式为C8H8O2,X的结构简式为______________。
(3)在上述五步反应中,属于取代反应的是_______________(填序号)。
(4)B的一种同分异构体满足下列条件:
Ⅰ、能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ、分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式:_______________。
(5)根据已有知识并结合相关信息,写出以 为原料制备
为原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
![]()
合成路线流程图第一步已给出,请补充完整。
 _________________________________________。
_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是
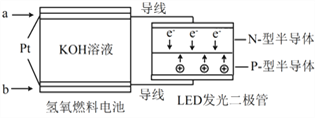
A. a处通入氧气, b处通氢气
B. 通入H2的电极发生反应:H2-2e- = 2H+
C. 通入O2的电极发生反应:O2 + 4e- + 2H2O = 4OH-
D. 该装置将化学能最终转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰基扁桃酰氯是一种医药中间体。 某研究小组以甲苯和乙醇为主要原料,按下列路线合成乙酰基扁桃酰氯。

已知:

(1)甲苯与氯气反应生成 A的条件是________。
(2)物质 B中含有的官能团是________。
(3)物质 D 的结构简式是_________。
(4)下列说法正确的是________。
a.化合物 A不能发生取代反应
b.乙酰基扁桃酰氯属于芳香烃
c.化合物 C 能与新制的 Cu(OH)2发生反应
(5)E+F→G 的化学方程式是_______。
(6)化合物 D 有多种同分异构体,同时符合下列条件的同分异构体共有_______ 种,写出其中两种的同分异构体的结构简式_______。
①红外光谱检测表明分子中含有氰基(-CN);
②1H-NMR 谱检测表明分子中有苯环,且苯环上有两种不同化学环境的氢原子。
(7)设计以乙醇为原料制备 F 的合成路线(用流程图表示;无机试剂任选) _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于NO的说法错误的是
A. NO是红棕色气体
B. NO是汽车尾气的有害成分之一
C. NO难溶于水,可用排水法收集
D. NO能够与入体血红蛋白结合,造成人体缺氧中毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中,各物质浓度随时间变化的关系如图1所示。

请回答:
(1)下列选项中不能说明该反应已达到平衡状态的是____________(填选项字母)。
A.容器内混合气体的压强不随时间变化而改变
B.容器内混合气体的密度不随时间变化而改变
C.容器内混合气体的颜色不随时间变化而改变
D.容器内混合气体的平均相对分子质量不随时间变化而改变
(2)反应进行到10 min时,共吸收热量11.38 kJ,则该反应的热化学方程式为_________________;
(3)计算该反应的平衡常数K=___________________________________________。
(4)反应进行到20 min时,再向容器内充入一定量NO2,10min后达到新的平衡,此时测得c(NO2)=0.9 mol/L。
①第一次平衡时混合气体中NO2的体积分数为w1,达到新平衡后混合气体中NO2的体积分数为w2,则w1_______w2 (填“>”、“=”或“<”);
②请在图2中画出20 min后各物质的浓度随时间变化的曲线(曲线上必须标出“X”和“Y”)________。
II.(1)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:

该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的_______________极(填“正”或“负”),该电极反应式为_______________________________________。
(2)用此电池电解含有0.1 mol/L CuSO4和0.1 mol/L NaCl的混合溶液100 mL,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,阳极产生的气体在标准状况下的体积是__________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NOx是造成大气污染的主要物质,现在工业上脱硝有多种方法。试回答下列问题
I.采用NaClO2溶液作为吸收剂可进行脱硝。反应一段时间后溶液中离子浓度的分析结果如下表:

写出NaClO2溶液和NO反应的脱硝过程中主要反应的离子方程式:______________________.
Ⅱ.用焦炭还原法将其转化为无污染的物质也可进行脱硝。已知:
2C(s)+O2(g)=2CO(g) △H1=-221.0kJ·mol-1;
N2(g)+O2(g)=2NO(g) △H2=+180.5kJ/mol
2NO(g)+2CO(g)=2CO2(g)+N2 (g) △H3=-746.0kJ /mol
回答下列问题
(1)用焦炭还原NO生成无污染气体的热化学方程式为______________________.
(2)在一定温度下,向甲、乙、丙三个恒容密闭容器中加入一定量的NO和足量的焦炭,反应过程中测得各容器中c(NO)(mo/L)随时间(s)的变化如下表:(已知:三个容器的反应温度分别为T甲=400℃、T乙=400℃、T丙=a℃)

甲容器中,该反应的平衡常数K=_________丙容器的反应温度a__________400℃(填“>”,<”或“=”),理由是___________________________________.,用NH3催化还原NOx,也可以消除氮氧化物的污染。已知:8NH3(g)+6NO2(g)![]() 7N2(g)+12H2O(l),ΔH<0。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间的变化如图所示
7N2(g)+12H2O(l),ΔH<0。相同条件下,在2L密闭容器内,选用不同的催化剂进行反应,产生N2的量随时间的变化如图所示
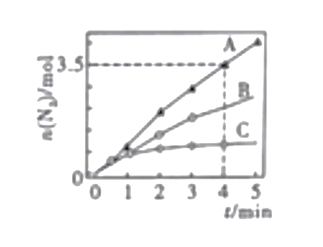
①在催化剂A的作用下0-4min的v(NO2)=___________________.
②该反应活化能Ea(A)、Ea(B)、Ea(C)由小到大的顺序是_____________,理由是_______________________________________.
③下列说法不正确的是____________(填序号)。
a.使用催化剂A达平衡时,△H值更大
b升高温度可使容器内气体颜色加深
c.单位时间内形成N-H键与O-H键的数目相等时,说明反应已经达到平衡
d.若在恒容绝热的密闭容器中反应,当平衡常数不变时,说明反应已经达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种既高效又干净的新能源,发展前景良好,用氢作能源的燃料电池汽车倍受青睐。我国拥有完全自主知识产权的氢燃料电池轿车“超越三号”,已达到世界先进水平,并加快向产业化的目标迈进。下列有关说法正确的是( )
A. 氢制备工艺廉价易行,且储存方便
B. 燃料电池车中能量转化率为100%
C. 燃料电池车是直接将化学能转化为电能
D. 利用热电厂的电能电解蒸馏水制备氢气是一种环保之举
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数之和为46,它们在周期表中的相对位置如图所示。下列说法正确的是

A. 原子半径大小顺序为:Y>Z>X
B. X元素最高价氧化物的水化物酸性最强
C. Y元素的简单氢化物稳定性最强
D. Z单质难溶于化合物WZ2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com