

 CO2+4HCl��
CO2+4HCl��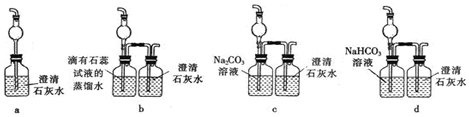
���� ����ͨ��װ��A�Ƶ�����������Ũ������лӷ����Ƶõ�����������BCװ����Ϊ�˳��ӣ�DEFװ��Ϊ��̽�����������ʣ�Gװ��Ϊ��ȷ����û�����������̼���ɣ��ݴ˷�����
��1����������B�Ĺ����ж������ƣ�
��2����Cl2+SO2+2H2O=2HCl+H2SO4�����ɵ����������Ȼ�����Ӧ���ɰ�ɫ�����ᱵ������������
��3��������ǿ�����ԣ�̼�л�ԭ�ԣ��ڼ���������������ˮ��̼����������ԭ��Ӧ��
��4���Ȼ��⡢������ͳ���ʯ��ˮ��Ӧ�����ɵ��κ�ˮ��
��5��ȷ��F����Ӧ����CO2���������ó����ʯ��ˮ�������֤�����ȥ������̼�е��Ȼ��⡢�������Ҳ������ɶ�����̼��
��6����̪�����죬����NaOH����ķ�Ӧ������������������������ü����μӼ�ķ��������ʵ�飬����ɫ�ָ�˵������к�ʹ����٣�����ɫ���ָ�����˵���Ǵ���������ã�
��� �⣺��1�����������Ĺ����֪BΪ������ƿ��
�ʴ�Ϊ��������ƿ
��2��Eװ�ò�����ɫ���������ԭ���������Ͷ���������������ԭ��Ӧ����Cl2+SO2+2H2O=2HCl+H2SO4���ɵ����������Ȼ�����Ӧ���ɰ�ɫ�����ᱵ������
�ʴ�Ϊ��Cl2+SO2+2H2O=2HCl+H2SO4�������Ȼ�����Ӧ���ɰ�ɫ�����ᱵ����
��2��������ǿ�����ԣ�̼�л�ԭ�ԣ��ڼ���������������ˮ��̼����������ԭ��Ӧ�����Ȼ���Ͷ�����̼����Ӧ����ʽΪ��2Cl2+C+2H2O  CO2+4HCl
CO2+4HCl
�ʴ�Ϊ��2Cl2+C+2H2O  CO2+4HCl
CO2+4HCl
��4��ʣ���������Eװ���к�ˮ��Ӧ��������ʹ����ᣬ�Ȼ��⡢������ͳ���ʯ��ˮ��Ӧ�����ɿ����Ե��κ�ˮ�����Է�Ӧ�����������ް�ɫ�������ɣ���
�ʴ�ѡ��d
��5������ͨ��Fװ�õ������к����������Ȼ��⡢������̼�������ȥ�������Ȼ��⣬�ҳ�ȥ��������������в��ܲ���������̼��װ��a�������Ȼ��⡢������̼һͬͨ����ȷ��F����Ӧ����CO2������dװ���Ȼ�����̼�����Ʒ�Ӧ���ɶ�����̼����ȷ��F����Ӧ����CO2������װ��c��̼�������Ȼ��ⷴӦ���ɶ�����̼����ȷ��F����Ӧ����CO2��������������������ˮ���Ȼ��⼫������ˮ��������̼�����Ȼ��⣬������̼��ˮ�в��ܣ���ˮ�ɳ�ȥ�������Ȼ����������壬��������������ʯ��ˮ���ñ���ǣ���ȷ��F����Ӧ����CO2������
�ʴ�Ϊ��b��
��6�����̪�����죬��������ˮ�������뺬��̪��NaOHϡ��Һ�У����ε����һ��ʱ��ɫͻȻ��ȥ�������Ϊԭ��һ����ˮ�еĴ��������Ư���ԣ���ǿ�����ԣ���ʹ��Һ��ɫ��ԭ�������ˮ�����ԣ�������������Һ�к�ʹ��Һ��ɫ��
�������Ư�����Һ�ټ�NaOH��Һ����ָ���ɫ�����������Һ�еμ�NaOH��Һ������Һ�ָ���ɫ��˵��ԭ�����ȷ������Һ��Ϊ��ɫ��˵��ԭ��һ��ȷ��
�ʴ�Ϊ����ˮ�еĴ��������Ư���ԣ���ǿ�����ԣ���ʹ��Һ��ɫ����ˮ�����ԣ�������������Һ�к�ʹ��Һ��ɫ��ȡD����ɫ�����Һ�������Թ��У���������������Һ������Һ��죬��Ϊԭ�������ȡD����ɫ�����Һ�������Թ��У������̪������Һ��죬��Ϊԭ��һ��
���� ���⿼��ʵ������ȡ�����������ʵ����ʣ���ȷ��Ӧԭ���ǽ����Ĺؼ�����Ŀ�Ѷȣ�


 Сѧ�̲�ȫ��ϵ�д�
Сѧ�̲�ȫ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| t/s | 0 | 2 | 4 | 6 | 8 |
| n��Z��/mol | 0 | 0.8 | 1.4 | 1.8 | 1.8 |
| A�� | ��ʹ�ô�������Ӧ���ʺ�X��ת���ʾ����� | |
| B�� | �����������䣬�����¶ȣ��ٴﵽƽ��ʱc��Z��=0.8 mol•L-1�����H��0 | |
| C�� | �����������䣬�������ѹ����1.0 L��ƽ�ⳣ�������� | |
| D�� | �¶Ȳ��䣬���������ٳ���2 mol X��1 mol Y����Ӧ�ﵽ��ƽ��ʱ $\frac{n��Z��}{n��Y��}$ ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1 mol OH-���9NA������ | |
| B�� | �����£�23 g NO2��N2O4�Ļ�������к���NA����ԭ�� | |
| C�� | 1 L 1 mol/L AlCl3��Һ�к���NA��Al3+ | |
| D�� | ���³�ѹ�£�11.2 L���������к��еķ�����Ϊ0.5NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������ȥ�����е�Ʈ�������ý������ӵĴ����Զ����Գ�ȥ | |
| B�� | ��Һ�ͽ����Ϊ�ʵ����Եķ�ɢϵ | |
| C�� | FeCl3��Һ��Fe��OH��3����ı��������Ǻ��߿��Բ������������ | |
| D�� | ���ڽ���֮����ų����ã��������ۼ��ɴ�Ŀ��������Խ���Ƚ��ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2CH4��g��+4O2��g����2CO2��g��+4H2O��1������H=+890kJ•mol-1 | |
| B�� | CH4��g��+2O2��g����CO2��g��+2H2O��1������H=+445kJ•mol-1 | |
| C�� | CH4��g��+2O2��g����CO2��g��+2H2O��1������H=+890kJ•mol-1 | |
| D�� | $\frac{1}{2}$CH4��g��+O2��g��=$\frac{1}{2}$CO2��g��+H2O��1������H=-445kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �۱�ϩ�Ľṹ��ʽΪ��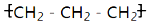 | B�� | �������Ľṹ��ʽ��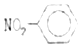 | ||
| C�� | �����ǵ�ʵ��ʽ��CH2O | D�� | ������ӵı���ģ�ͣ�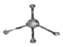 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com