
【题目】某纯碱样品中含有少量NaCl杂质,现用如图所示装置来测定纯碱样品中Na2CO3的质量分数(铁架台、铁夹等在图中均已略去;碱石灰是生石灰与氢氧化钠的混合物,可以吸收水和二氧化碳)。
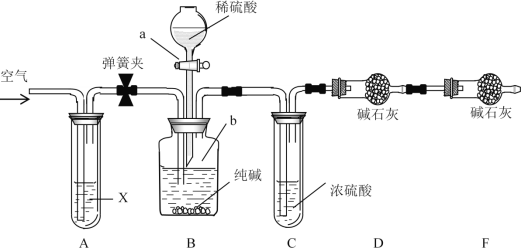
实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰的干燥管D的质量为80.20g;
③准确称得20.00g纯碱样品放入容器b中;
④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入一定量空气;
⑥然后称得干燥管D的总质量为86.36g ;
⑦重复步骤⑤和⑥的操作,直到干燥管D的质量不变,为86.80 g。
试回答:
(1)装置B中发生反应的离子方程式_________________________________;
(2)装置A中试剂X应选用足量的(______)
A.饱和NaCl溶液 B.浓H2SO4
C.NaHCO3溶液 D.NaOH溶液
(3)①请用文字叙述装置C的作用:__________________________________。
②请用文字叙述装置E的作用:__________________________________。
(4)如果将分液漏斗中的硫酸换成浓度相同的盐酸,则会导致测定结果_____(填“偏大”、 “偏小”或“不变”,下同);若没有操作⑤⑦,则会导致测定结果__________。
(5)根据实验中测得的有关数据,计算出纯碱样品Na2CO3的质量分数为_________。
【答案】2H++CO32- = H2O+CO2↑ (2) 吸收CO2气体中的水蒸气,避免测量结果产生误差(偏大) 防止空气中的水或CO2进入D引起测量误差(偏大) 偏大 偏小 79.5%
【解析】
B中发生发反应:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,C中浓硫酸干燥二氧化碳,D中碱石灰增重为生成二氧化碳的质量,进而计算样品中碳酸钠的质量分数。通入空气排尽装置中二氧化碳,使二氧化碳进入D中完全吸收,空气中的二氧化碳会影响实验,A中盛放浓氢氧化钠溶液可以除去空气中二氧化碳。F装置吸收空气中的二氧化碳、水蒸气,防止加入D中影响二氧化碳质量测定。
(1)在装置B中,硫酸与碳酸钠发生复分解反应,产生硫酸钠、二氧化碳和水,发生反应的离子方程式是2H++CO32- =H2O+CO2↑;
(2)鼓入空气可以将装置内残留的二氧化碳全部排出进入D装置,达到精确测量的目的;装置A中试剂X可以除去空气中的二氧化碳,防止干扰物质含量的测定,达到精确测量的目的,应选用浓NOH溶液,选项D合理;
(3)①B中生成二氧化碳中混有水蒸气,若没有C装置中盛有的浓硫酸来吸收,D中碱石灰就吸收二氧化碳与水蒸气,导致测定二氧化碳的质量偏大,样品中碳酸钠的质量分数会偏大;
②装置E盛有碱石灰,可以吸收空气中的二氧化碳和水蒸气,防止空气中的水或CO2进入D引起测量误差(偏大);
(4)如果将分液漏斗中的硫酸换成浓度相同的盐酸,由于HCl具有挥发性,它会与碱石灰发生反应,导致测定结果偏大;若没有操作⑤⑦,碳酸钠反应产生的部分二氧化碳气体会在装置中滞留,使测定结果偏小;
(5)生成二氧化碳的质量为m(CO2)=86.80 g-80.20g=6.60g,其物质的量为n(CO2)=6.60g÷44g/mol=0.15mol,根据碳原子守恒可知样品中碳酸钠的质量为m(Na2CO3)=0.15mol×106g/mol=15.9g,则纯碱样品Na2CO3的质量分数为:(15.9g÷20.00g) ×100%=79.5%。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种常见的金属单质,A在空气中燃烧生成淡黄色固体;B为红色固体,锈蚀时变为绿色;C在空气中加热熔化但不滴落;D在氧气中燃烧,火星四射。
根据以上信息回答下列问题:
(1)写出对应化学式:A______,B______,C______,D______。
(2)A在室温下与氧气反应时生成__________(写化学式,下同),D在空气中锈蚀生成__________。
(3)写出下列化学方程式:
①A在空气中燃烧______________________;
②B与氧气在加热条件下反应______________________;
③C在氧气中燃烧________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2![]() 2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )
2NO+O2 在恒容密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n molO2的同时,生成2n molNO2
②单位时间内生成n molO2 的同时,生成2n mol NO
③用NO2、NO、O2 的物质的量浓度变化表示的反应速率的比为2 : 2 : 1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥ 混合气体的平均相对分子质量不再改变的状态
A. ①④⑥ B. ②③⑤ C. ①③④ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答以下问题:
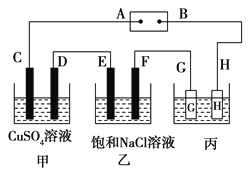
(1)电极A是__________________(填“正极”或“负极”)。
(2)甲装置中电解反应的总化学方程式是_______________。
(3)若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56 mL(标准状况下)气体,电解后溶液体积为500 mL时,求所得溶液在25℃时的pH=__________________。
(4)欲用丙装置给铜镀银。G应该是___(填“银”或“铜”),电镀液的主要成分是______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列A、B、C、D是中学常见的混合物分离或提纯的基本装置。
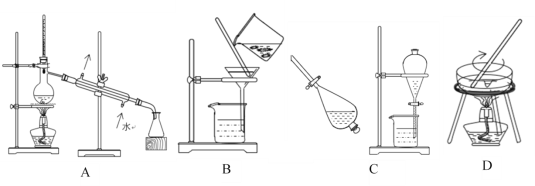
请根据混合物分离或提纯的原理,回答下列问题:
①以上四种化学实验操作的名称依次是:______、______、______、_______。
②分离CCl4(沸点:76.75℃)和苯(沸点:110.6℃)的混合物(互溶)应选用________;(填装置字母)
③在使用C进行化学实验操作前,应先____________。
(2)实验室现需要480ml 0.10mol/L的NaOH溶液,就配置该溶液回答下列问题:
①用托盘天平称量NaOH固体___________g。
②称量必需迅速,原因是__________________________________________。
③将配置好的溶液准确取出480ml后,将剩余溶液取出加水稀释至100ml保存于试剂瓶中,请给它贴上标签,标签上的内容是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5 L某浓度的NaCl溶液中含有0.5 mol NaCl,下列对该溶液的说法中,不正确的是
A. 该溶液溶质的物质的量浓度为1 mol·L-1
B. 该溶液中含有58.5 g NaCl
C. 配制100 mL该溶液需用5.85 g NaCl
D. 量取100 mL该溶液倒入烧杯中,烧杯中的NaCl物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池的电极材料分别为Pb和PbO2,电解质溶液为30% H2SO4。下图是处于工作状态的铅蓄电池示意图,若两电极的质量都增加且a极增加得更多。下列说法正确的是

A. a为铅蓄电池的正极
B. b电极发生的反应为PbO2+4H++SO42-+2e-=PbSO4+2H2O
C. 该铅蓄电池正在充电
D. 工作一段时间后,溶液的pH不断减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,2.24LH2O中含有共价数目为2NA
B. NA个氧气分子与NA个氢分子的质量比为8:1
C. 8gCuO与足量H2充分反生成Cu,该反应转移的电子数为0.2NA
D. 4.6g金属钠与500mL 0.2mol/L的盐酸充分反应,转移电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol I2(g) 和2 mol H2置于2L密闭容器中,在一定温度下发生反应: I2(g) + H2(g) ![]() 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示,则:
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示,则:
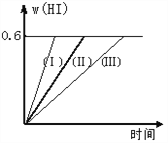
(1)达平衡时,I2(g)的物质的量浓度为___________ 。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,在乙条件下w(HI)的变化如曲线(Ⅲ) 所示。则甲条件可能是___________,则乙条件可能是___________ 。(填入下列条件的序号)
①恒容条件下,升高温度; ②恒容条件下,降低温度;
③恒温条件下,缩小反应容器体积;
④恒温条件下,扩大反应容器体积;
⑤恒温恒容条件下,加入适当催化剂。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com