
| A. | MOH的物质的量一定等于HA的物质的量 | |
| B. | MOH的物质的量一定小于HA的物质的量 | |
| C. | 反应后溶液中c(M+)一定大于c(A-) | |
| D. | 反应后溶液中c(M+)一定等于c(A-) |
分析 在一元强碱MOH的溶液中,加入一种一元酸HA溶液,当反应后溶液呈现中性,则溶液中存在c(OH-)=c(H+),根据电荷守恒得c(A-)=c(M+);如果酸是弱电解质,要使混合溶液呈中性,则酸的物质的量应稍微大些;如果酸是强电解质,则酸碱的物质的量相等,据此分析解答.
解答 解:在一种一元强碱MOH的溶液中,加入一种一元酸HA溶液,当反应后溶液呈现中性,c(OH-)=c(H+),根据电荷守恒得c(A-)=c(M+),
A.如果酸是弱电解质,要使混合溶液呈中性,则酸的物质的量应稍微大些;如果酸是强电解质,则酸碱的物质的量相等,故A错误;
B.若酸为弱酸,则酸的物质的量大于MOH,若酸为强酸,则MOH与HA的物质的量相等,故B错误;
C.反应后溶液呈现中性,c(OH-)=c(H+),根据电荷守恒得c(A-)=c(M+),故C错误;
D.通过以上分析知,反应后溶液中c(A-)=c(R+),故D正确;
故选D.
点评 本题考查酸碱混合的定性判断,题目难度中等,明确电荷守恒的含义为解答关键,注意掌握弱电解质的电离平衡,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:解答题
 含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料.现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该反应中,N2是氧化剂,Al2O3是还原剂 | |
| B. | 在该反应中,每当生成2molAlN,N2失去6mol电子 | |
| C. | 氮化铝中氮元素的化合价为-3价 | |
| D. | 碳元素化合价升高,所以CO是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④⑤ | B. | ②⑤⑥ | C. | ②③④ | D. | ①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
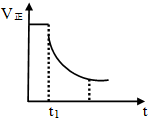
| A. | 降低温度 | B. | 减小压强 | C. | 减小SO3的浓度 | D. | 增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com