
| A. | 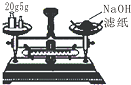 称量25g氢氧化钠 称量25g氢氧化钠 | B. | 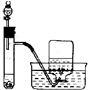 H2O2溶液制备O2 | C. | 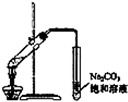 乙酸乙酯的制备 乙酸乙酯的制备 | D. | 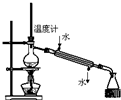 石油蒸馏 |
分析 A.托盘天平使用时,左盘放物品,右盘放砝码;
B.双氧水在二氧化锰催化条件下反应制备氧气,氧气难溶于水;
C.长导管不能插入饱和碳酸钠液面以下;
D.依据蒸馏实验中冷凝水从下口进入,上口流出.
解答 解:A.使用天平应遵循“左物右码”原则,药品放在左盘,氢氧化钠为腐蚀品,应放在烧杯中称量,故A错误;
B.双氧水在二氧化锰催化条件下反应制备氧气,氧气难溶于水,可以用排水法收集,故B 正确;
C.长导管不能插入饱和碳酸钠液面以下,容易发生倒吸,故C错误;
D.蒸馏时,冷凝水应下口进上口出,故D错误;
故选:B.
点评 本题考查化学实验基本操作,熟悉实验原理及常见仪器的使用方法即可解答,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | K3Cr2Cl7 | B. | K3Cr2Cl5 | C. | K3Cr2Cl9 | D. | K2CrCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
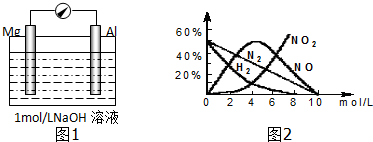
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入Ne | B. | 通入NO2 | C. | 通入N2O4 | D. | 以上都不行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 往FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- | |
| B. | Fe(OH)2溶于稀HNO3中:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | Fe2O3溶与足量的氢溴酸:Fe2O3+6H++2Br-═2Fe2++Br2+3H2O | |
| D. | HCl滴入NaAlO2溶液中:AlO2-+H++H2O=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
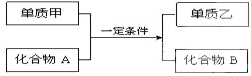
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用饱和食盐水和浓硫酸共热制备HCl气体 | |
| B. | 将H2和Cl2混合,在光照条件下反应,用于工业制备盐酸 | |
| C. | 将Cl2通入饱和石灰水,用于工业生产漂白粉 | |
| D. | 实验室用稀NaOH溶液吸收实验过程中多余的Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有放热的氧化还原反应才能设计成原电池,并将电能转化为化学能 | |
| B. | 电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同组成了一个完整的闭合回路 | |
| C. | 无论在原电池还是在电解池中,电子均不能通过电解质溶液 | |
| D. | 原电池的负极失去电子的总数等于正极得到电子的总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用以下实验器材(规格和数量不限):烧杯、玻璃棒、胶头滴管、分液漏斗,能完成用溴水和CCl4除去NaBr溶液中的少量NaI的实验 | |
| B. | 制备硫酸亚铁晶体时,最后在蒸发皿中蒸发浓缩溶液时,只需小火加热至溶液被全部蒸干 | |
| C. | 向两支盛有KI3溶液的试管中分别加入淀粉和硝酸银溶液,前者溶液变蓝后者产生黄色沉淀,由此得出KI3溶液中存在平衡I3-?I2+I- | |
| D. | 科学家在研究物质微观结构的过程中先后使用了光学显微镜、电子显微镜、扫描隧道显微镜等观测仪器 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com