

分析 废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,不溶物为Fe,溶液A调节pH使溶液中ZnO22-转化为Zn(OH)2沉淀,再经过抽滤、洗涤、干燥,灼烧得到ZnO.不溶物Fe中加入硫酸,反应生成硫酸亚铁,调节溶液PH=1~2,并加入适量过氧化氢,氧化部分亚铁离子为铁离子,得到含Fe2+、Fe3+的B溶液,再加入氢氧化钠溶液,加热分解生成四氧化三铁胶体粒子.
(1)Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层和去除油污作用;
(2)调节溶液A的pH可产生Zn(OH)2沉淀,抽滤就可以得到氢氧化锌沉淀,高温灼烧氢氧化锌分解得到ZnO;
(3)持续通入N2,防止Fe2+被氧化;
(4)根据m=cVM计算m(K2Cr2O7);
根据溶液浓度的精度,应选择电子天平用于称量固体质量,烧杯用于溶解固体,玻璃棒用于搅拌和引流操作,用250mL容量瓶用于配置溶液,胶头滴管用于加水定容.
解答 解:废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,不溶物为Fe,溶液A调节pH使溶液中ZnO22-转化为Zn(OH)2沉淀,再经过抽滤、洗涤、干燥,灼烧得到ZnO.不溶物Fe中加入硫酸,反应生成硫酸亚铁,调节溶液PH=1~2,并加入适量过氧化氢,氧化部分亚铁离子为铁离子,得到含Fe2+、Fe3+的B溶液,再加入氢氧化钠溶液,加热分解生成四氧化三铁胶体粒子.
(1)根据Zn及化合物的性质与Al及化合物的性质相似,Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层和去除油污作用,
故答案为:AB;
(2)调节溶液A的pH可产生Zn(OH)2沉淀,抽滤就可以得到氢氧化锌沉淀,洗涤除去附着的离子,高温灼烧氢氧化锌分解得到ZnO,
故答案为:抽滤、洗涤、灼烧;
(3)持续通入N2,防止Fe2+被氧化,故答案为:在N2气氛下,防止Fe2+被氧化;
(4)m(K2Cr2O7)=0.01000mol•L-1×0.250 L×294.0 g•mol-1=0.7350g;
根据溶液浓度的精度,应选择电子天平用于称量固体质量,烧杯用于溶解固体,用玻璃棒搅拌,恢复室温,用玻璃棒引流,移入250mL容量瓶中,继续加水至离刻度线1-2cm处,改用胶头滴管加水定容,故用不到的仪器为量筒和移液管,
故答案为:0.7350g;③⑦.
点评 本题以“废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO”为载体,考查实验基本操作和技能,涉及标准溶液的配制、对信息的利用、实验条件的控制等,试题难度中等,是对学生综合能力的考查,需要学生基本知识的基础与分析问题、解决问题的能力.


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案科目:高中化学 来源: 题型:解答题
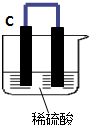 如图所示,将锌、铜通过导线相连置于稀硫酸中.
如图所示,将锌、铜通过导线相连置于稀硫酸中.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) 滴定前读数(mL)滴定后读数(mL) | |
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
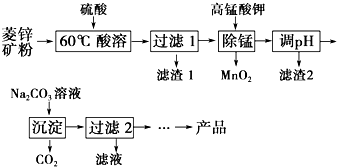 以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:
以菱锌矿(主要成分为ZnCO3,同时含有MnO、FeO、Fe2O3、SiO2等杂质)为原料生产碱式碳酸锌[ZnCO3•2Zn(OH)2•H2O]的工艺流程如图.已知Fe2+、Fe3+、Zn2+生成氢氧化物沉淀的pH见表:| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ |
| 开始沉淀时pH | 5.8 | 1.1 | 5.9 |
| 完全沉淀时pH | 8.8 | 3.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:请完成下列填空:| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中通入过量的CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| C. | 向NaHCO3溶液中加过量Ca(OH)2溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡静置后,分液 | |
| B. | 乙醇(水):加入新制生石灰,蒸馏 | |
| C. | 溴苯(溴):加入CCl4溶液,充分振荡静置后,分液 | |
| D. | 苯中混有苯酚,加入氢氧化钠溶液,再用分液漏斗分液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com