
| A. | 2Fe3++Cu=2Fe2++Cu2+成立说明氧化性:Fe3+>Cu2+ | |
| B. | 25℃,pH=0的溶液中,Al3+、NH4+、NO3-、Fe2+可以大量共存 | |
| C. | 5.6g铁与足量的氯气反应失去电子为0.2mol | |
| D. | 硫酸铁溶液中加入铁粉,滴加KSCN溶液一定不变血红色 |
分析 A.氧化剂的氧化性大于氧化产物的氧化性;
B.pH=0的溶液中存大大量的氢离子,H+、NO3-、Fe2+发生氧化还原反应;
C.氯气与铁反应生成氯化铁,1mol的铁转移3mol的电子;
D.硫酸铁溶液中加入铁粉,发生氧化还原反应生成二价铁,但当铁少量三价铁还有剩余.
解答 解:A.2Fe3++Cu=2Fe2++Cu2+反应中三价铁离子为氧化剂,Cu2+为氧化产物,所以氧化性:Fe3+>Cu2+,故A正确;
B.pH=0的溶液中存在大量的氢离子,H+、NO3-、Fe2+发生氧化还原反应,三者不能大量共存,故B错误;
C.5.6 g铁的物质的量为0.1 mol与足量的氯气反应失去的电子为0.3 mol,故C错误;
D.硫酸铁溶液中加入铁粉,发生氧化还原反应生成二价铁,但当铁少量三价铁还有剩余,所以滴加KSCN溶液可能变血红色,故D错误;
故选A.
点评 本题考查了元素化合物知识,为高频考点,侧重于学生的分析、计算能力的考查,明确铁及其化合物的性质是解题关键,注意C选项,氯气与铁反应只生成氯化铁.


科目:高中化学 来源: 题型:选择题
| A. | 5个 | B. | 3个 | C. | 2个 | D. | 1个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加H2的量 | |
| B. | 将容器体积缩小一半 | |
| C. | 保持容器内体积不变,充入Ar使体系压强增大 | |
| D. | 充入Ar,保持容器内压强不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
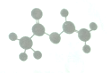 法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖:轮烷是一种分子机器的一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )
法国、美国、荷兰的三位科学家因研究“分子机器的设计与合成”获得2016年诺贝尔化学奖:轮烷是一种分子机器的一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列说法正确的是( )| A. | 该化合物的名称为乙酸乙酯 | |
| B. | 该化合物可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且反应类型相同 | |
| C. | 该化合物既能发生取代反应,又能发生加成反应和氧化反应 | |
| D. | 该化合物的同分异构体中,能与NaHCO3反应放出CO2的只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2 和 CO | B. | CO2 和 N2O | C. | O3 和 CO2 | D. | CO32- 和 NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.4g铜在足量的氯气中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,2.24L乙醇中含有的氧原子数为0.1NA | |
| C. | 2.0gH218O与D216O的混合物中所含质子数为NA | |
| D. | 0.1L0.5 mol•L-1CH3COOH溶液中含有的H+数为0.05NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 将一块质量为5.0g的铝片投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图所示的曲线来表示,回答下列问题:
将一块质量为5.0g的铝片投入盛有500mL 0.5mol•L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图所示的曲线来表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液与盐酸:CO32-+2 H+═H2O+CO2↑ | |
| B. | 向澄清的石灰水中加入过量的小苏打溶液:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| C. | 向硝酸亚铁溶液中加入稀硫酸:Fe2++4H++NO3-═Fe3++NO↑+2H2O | |
| D. | AlCl3溶液与过量氨水反应:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com