
| A. | CH3CH=CHCH3分子中的四个碳原子在同一直线上 | |
| B. | 按系统命名法, 的名称为4,4-二甲基-3-乙基己烷 的名称为4,4-二甲基-3-乙基己烷 | |
| C. | 满足分子式为C4H8ClBr的有机物有11种 | |
| D. | 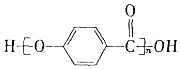 的结构中含有酯基 的结构中含有酯基 |
分析 A.CH3CH=CHCH3分子中的四个碳原子和乙烯分子中4个氢原子两个碳原子结构相似为平面结构,键角120°;
B.物质为烷烃,选取最长碳链为主碳链,离取代基近的一端编号,由简到繁书写名称;
C.C4H8ClBr可以可知丁烷中的2个H原子分别为1个Cl、1个Br原子取代,丁烷只有2种结构,氯原子与溴原子可以取代同一碳原子上的H原子,可以取代不同碳原子上的H原子,据此书写判断;
D.物质是酸脱羟基醇脱氢发生酯化反应形成的高分子化合物,
解答 解:A.CH3CH=CHCH3分子中的四个碳原子和乙烯分子中4个氢原子两个碳原子结构相似为平面结构,四个碳原子不在同一直线上,故A错误;
B.按系统命名法, 的名称为3,3-二甲基-4-乙基己烷,故B错误
的名称为3,3-二甲基-4-乙基己烷,故B错误
C.先分析碳骨架异构,分别为 C-C-C-C 与 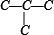 2种情况,然后分别对 2 种碳骨架采用“定一移一”的方法分析,其中骨架 C-C-C-C 有
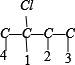
2种情况,然后分别对 2 种碳骨架采用“定一移一”的方法分析,其中骨架 C-C-C-C 有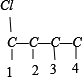 、
、 共 8 种,骨架
共 8 种,骨架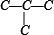 有
有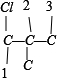 、
、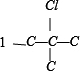 ,共 4 种,共12种,故C错误;
,共 4 种,共12种,故C错误;
D.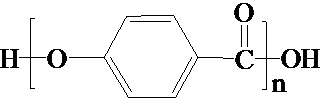 的形成是酸脱羟基醇脱氢形成,结构中含有酯基,故D正确;
的形成是酸脱羟基醇脱氢形成,结构中含有酯基,故D正确;
故选D.
点评 本题考查了有机物的结构特征、同分异构体书写、命名方法、高分子化合物形成的特征分析判断,掌握基础是解题关键,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 石灰石与稀盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-=BaSO4↓ | |
| C. | 氯化铁溶液与氢氧化钠溶液反应:Fe3++3OH-=Fe(OH)3↓ | |
| D. | 稀硝酸溶液与铜反应:Cu+4H++NO3-=Cu2++2H2O+NO↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 燃料的燃烧都是放热反应 | |
| B. | 氯化钾的电子式为: | |
| C. | 决定化学反应速率的主要因素是反应物的浓度 | |
| D. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
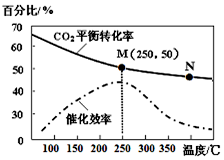 甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
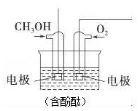 将甲醇与氧气分别通入如图所示的装置的电极中,可构成甲醇燃料电池,请回答下列问题:
将甲醇与氧气分别通入如图所示的装置的电极中,可构成甲醇燃料电池,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它在周期表的第5周期,第IA族 | |
| B. | 氢氧化铷是弱碱,是一种离子化合物 | |
| C. | 铷的一种核素${\;}_{37}^{86}$Rb原子核内的中子数与电子数之差49 | |
| D. | 在钠、钾、铷三种单质中,铷的熔点最高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com