
钛由于具有密度小、强度高、耐高温、抗腐蚀性强等优点,在现代科学技术上有着广泛的用途。工业上常用钛铁矿(主要成分为FeTiO3,同时含有铁的氧化物)为原料,经过一系列反应来制得钛,其流程大致如下。其中反应②目的是使Ti4+与水作用生成Ti(OH)4沉淀。阅读下述流程,完成下列填空: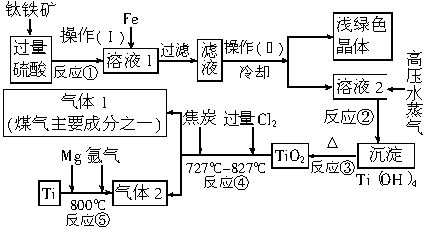
(1)操作(Ⅰ)中Fe的作用是____________,反应的离子方程式是_________________。
(2)操作(Ⅱ)的名称是______,得到的浅绿色晶体的化学式是__________________。
(3)写出反应④总的化学方程式(最终Ti的化合价不变):_____________________________。
(4)写出反应⑤的化学方程式:______________,
通入氩气的作用是____________________________。
(5)根据所提供的有关信息,你认为钛的用途之一是(指尖端科学技术)________________________。
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com