
甲酸甲酯水解反应方程式为:HCOOCH3+H2O![]() HCOOH+CH3OH-Q(Q>0)某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始量如下表.甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
HCOOH+CH3OH-Q(Q>0)某小组通过实验研究该反应(反应过程中体积变化忽略不计).反应体系中各组分的起始量如下表.甲酸甲酯转化率在温度T1下随反应时间(t)的变化如下图:
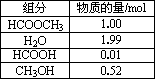
1.上述反应的平衡常数表达式为K=________.
2.计算15~20 min范围内:甲酸甲酯的减少量为________mol,甲酸甲酯的平均反应速率为________mol/min;80~90 min范围内甲酸甲酯的平均反应速率为________mol/min.
3.依据以上数据,推断该反应在10 min后反应速率迅速加快的原因:________.
4.其他条件不变,提高温度为T2,在答题卡框图中画出温度T2下甲酸甲酯转化率随反应时间变化的预期结果示意图.
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
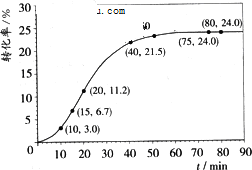
 (2013?保定一模)甲酸甲酯水解反应方程武为:HCOOCH3(aq)+H2O(l)?HCOOCH(aq)+CH3OH(aq)△H>0.某温度下,VL溶液中各组分的起始量如表:HCOOCH3转化率随反 应时间(t)的变化如图(假设溶液体积不变)下列说法正确的是( ) (2013?保定一模)甲酸甲酯水解反应方程武为:HCOOCH3(aq)+H2O(l)?HCOOCH(aq)+CH3OH(aq)△H>0.某温度下,VL溶液中各组分的起始量如表:HCOOCH3转化率随反 应时间(t)的变化如图(假设溶液体积不变)下列说法正确的是( )
|
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省保定市高三第一次模拟考试理综化学试卷(解析版) 题型:选择题
甲酸甲酯水解反应方程武为:HCOOCH3(aq)+H2O(l) HCOOH(aq)+CH3OH(aq)
△H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是
HCOOH(aq)+CH3OH(aq)
△H>0。某温度下,VL溶液中各组分的起始量如下表,HCOOCH3转化率随反应时间(t)的变化如下图(假设溶液体积不变),下列说法正确的是

A.温度升高,该反应的平衡常数减小
B.0〜10min,HCOOCH3 的平均反应速率 u=0. 003mol·L-1 • min-1
C.HCOOCH3平均反应速率先是增大,后减小,最后保持不变
D.80min时,反应刚达平衡,反应物转化率保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com