
 已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1
已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol-1| A. | 反应②中的能量变化如图所示,则△H2=E1-E3 | |
| B. | H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1mol N2和3mol H2,反应后放出的热量为Q1 kJ,若通入2mol N2和6mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨的催化氧化反应为4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
分析 A、反应②是放热反应,焓变=生成物总能量-反应物总能量;
B、燃烧热是1mol可燃物完全反应生成稳定氧化物放出的热量,反应③生成的水时水蒸气,不是稳定的氧化物;
C、合成氨的反应为可逆反应,压强增大平衡向正反应方向移动,92.4kJ•mol-1为生成2mol氨气时放出的热量;
D、由已知热化学方程式根据盖斯定律构造目标热化学方程式.
解答 解:A、反应热等于生成物的总能量-反应物的总能量,因此△H2=E1-E2,故A错误;
B、氢气的燃烧热为101kp条件下,1mol氢气完全燃烧生成液态水时放出的热量,241.8 kJ•mol-1为1mol氢气完全燃烧生成气态水时放出的热量,故B错误;
C、合成氨的反应为可逆反应,压强增大平衡向正反应方向移动,因此Q2>2Q1,92.4kJ•mol-1为生成2mol氨气时放出的热量,可逆反应不能进行到底,因此92.4×2>Q2,故C正确;
D、已知:①N2(g)+O2(g)=2NO(g)△H=+180kJ/mol
②N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
③2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol
由盖斯定律可知,①×2-②×2+③×3得:4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-906kJ/mol,故D错误;
故选:C.
点评 本题考查反应热和焓变的计算以及化学平衡移动对反应热的影响,难度中等,其中C为本题的难点,综合性较强.


科目:高中化学 来源: 题型:解答题
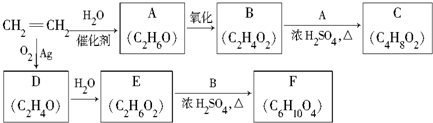
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
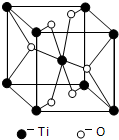 第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.
第四周期过渡元素Mn、Fe、Ti可与C、H、O形成多种化合物.| 元素 | Mn | Fe | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | vA=0.5mol/(L•s) | B. | vB=0.2mol/(L•s) | C. | vC=0.9mol/(L•s) | D. | vD=1.1mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
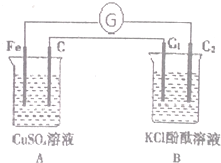 按图装置进行试验时,观察到电流指针发生偏转,B池中C2极区溶液变红,回答下列问题(C,C1,C2均为石墨电极)
按图装置进行试验时,观察到电流指针发生偏转,B池中C2极区溶液变红,回答下列问题(C,C1,C2均为石墨电极)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com