
科目:高中化学 来源: 题型:选择题
| A. | BaSO4在医学上用作“钡餐”,Ba2+对人体无害 | |
| B. | 高锰酸钾溶液、酒精、双氧水都能杀菌消毒,消毒原理相同,都利用了强氧化性 | |
| C. | 光导纤维的主要成分是单质硅,太阳能电池使用的材料是SiO2 | |
| D. | “地沟油”禁止食用,但可以用来制肥皂或燃油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
| A. | NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+)-c(OH-)=c(HCO3-)+2c(CO32-) | |
| B. | 25℃时,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 | |
| C. | 25℃时,若同浓度的醋酸和氢氧化钠等体积混合,所得溶液pH=8,则 c(Na+)-c(CH3COO-)=9.9×10-7mol/L | |
| D. | 25℃时,0.1mol/L的各溶液的pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | (CH3)2CHCH2CH2CH3 | B. | (CH3CH2)2CHCH3 | C. | (CH3)2CHCH(CH3)2 | D. | (CH3)3CCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
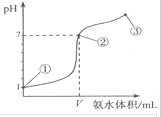 常温下,向20mL某浓度的盐酸中逐滴加入0.1mol.L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下列叙述正确的是( )
常温下,向20mL某浓度的盐酸中逐滴加入0.1mol.L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示,下列叙述正确的是( )| A. | 用0.1mol/LNa0H溶液代替氨水滴定盐酸达到点②时所消耗的Na0H的体积也是VmL | |
| B. | 从开始滴定后的任意一点:溶液中一定存在c(NH4+)+c(H+)=c(Cl-)+c(OH-) | |
| C. | 从点①到点③的滴定过程中:水的电离程度都增大 | |
| D. | 在点②所示溶液中:c(Cl-)=c(NH4+)>c(H+),且V=20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有反应:A.CaCO3═CaO+CO2
现有反应:A.CaCO3═CaO+CO2 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
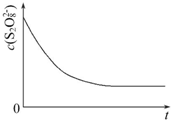 碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要应用,某兴趣小组用0.50mol•L-1 KI、0.2%淀粉溶液、0.20mol•L-1 K2S2O8、0.10mol•L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响.| 实验序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3 | B. | FeCl3 | C. | FeCl2 | D. | MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Fe2+、SCN-、Br-可以大量共存 | |
| B. | 和KI溶液反应的离子方程式:Fe3++2I-═Fe2++I2 | |
| C. | 1 L 0.1 mol•L-1该溶液和足量的Zn充分反应,生成11.2 g Fe | |
| D. | 和Ba(OH)2溶液反应的离子方程式:Fe3++SO42-+Ba2++3OH-═Fe(OH)3↓+BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com