

分析 软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物),二氧化硫能与二氧化锰反应生成硫酸锰,用MnCO3能除去溶液中Al3+和Fe3+,MnS将铜、镍离子还原为单质,高锰酸钾能与硫酸锰反应生成二氧化锰,通过过滤获得二氧化锰,
(1)废弃物二氧化硫导致酸雨,则脱硫能减少酸雨;
(2)KMnO4+MnSO4→MnO2的反应中,只有Mn元素的化合价变化,+7价降到+4价,+2价升高到+4价,根据升降总数相等确定氧化剂与还原剂之比;
MnCO3消耗溶液中的酸,促进Al3+和Fe3+水解;
(3)根据盖斯定律将③-②-①可得;
(4)锰离子在阳极失电子生成二氧化锰;
(5)二氧化锰得电子在碱溶液中生成MnO(OH);以石墨为电极电解硫酸铜溶液时,阳极上氢氧根离子放电,阴极上铜离子放电,SO42-向阳极移动.
解答 解:(1)脱硫能减少酸雨和废物再利用,白色污染的减少是塑料的减少和流程无关,
故答案为:ac;
(2)KMnO4+MnSO4→MnO2的反应中,只有Mn元素的化合价变化,+7价降到+4价,+2价升高到+4价,则需要2个+7价的Mn降低,3个+4价的Mn升高,氧化剂得电子化合价降低,还原剂失电子化合价升高,则氧化剂与还原剂的物质的量之比为2:3,
故答案为:2:3;
(3)Mn(s)+O2(g)═MnO2(s)△H=-520kJ•mol-1
S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1
Mn(s)+S(s)+2O2(g)═MnSO4(s)△H=-1065kJ•mol-1
将③-②-①可得MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol,
故答案为:MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol;
(4)锰离子在阳极失电子生成二氧化锰,电极反应式为Mn2++2H2O-2e-=MnO2+4H+,
故答案为:Mn2++2H2O-2e-=MnO2+4H+;
(5)二氧化锰得电子在碱溶液中生成MnO(OH),电极反应式为MnO2+H2O+e-=MnO(OH)+OH-;以石墨为电极电解硫酸铜溶液时,阳极上氢氧根离子放电、阴极上铜离子放电,所以阳极上生成O2,同时有大量的H+生成,且SO42-也向阳极移动在阳极积累,因此阳极产物还有H2SO4,
故答案为:MnO2+H2O+e-=MnO(OH)+OH-;O2、H2SO4.
点评 本题考查废气物处理的综合应用,为高频考点,涉及氧化还原反应、热化学方程式、原电池、电解池等知识,侧重分析能力、计算能力的考查,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:解答题
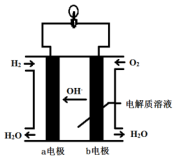 英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池.如图为碱性氢氧燃料电池结构示意图.
英国一家公司正在研发全球首款“充一次电,用七天”的碱性氢氧燃料手机电池.如图为碱性氢氧燃料电池结构示意图.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁表面镀锌可增强其抗腐蚀性 | |
| B. | 二氧化硅是将太阳能转变为电能的常用材料 | |
| C. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 | |
| D. | 酒精能使蛋白质变性,可用于杀菌消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 (1)溶液的pH除了可以通过实验得出的具体数据计算得到,在实验室中还可以用pH试纸或pH计来测量得到.
(1)溶液的pH除了可以通过实验得出的具体数据计算得到,在实验室中还可以用pH试纸或pH计来测量得到.| 滴定次数 | 待测液体积(mL)[来源 | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 1000mL 0.1mol/L HCOONa溶液 |
| 乙 | 1000mL 0.1mol/L CH3COONa溶液 |
| 丙 | 1000mL含HCOONa、CH3COONa各0.05mol的溶液 |
| A. | 溶液中c(Na+):甲=乙>丙 | |
| B. | 溶液中阴、阳离子和酸分子总数:甲<丙<乙 | |
| C. | 溶液pH:甲<丙<乙 | |
| D. | 溶液中阴、阳离子总数:甲>丙>乙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com