
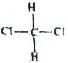
 和
和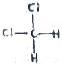
分析 同种元素的不同原子间互称同位素;
由同一种元素形成的不同单质互称同素异形体;
分子式相同而结构不同的化合物互称同分异构体;
分子式相同结构也相同的物质为同一种物质.据此分析.
解答 解:①CH3CH2OH和CH3OCH3 的分子式相同而结构不同,故互为同分异构体;
②D和T是同种元素的不同原子,故为同位素;
③16O2和18O2 分子式相同结构也相同的物质,故为同一种物质;
④干冰和CO2 分子式相同结构也相同的物质,故为同一种物质;
⑤白磷和红磷是由同一种元素形成的不同单质,故为同素异形体;
⑥H2O和H2O2既不是同位素,也不是同素异形体,也不是同分异构体和同一种物质,两者没有关系;
⑦ 和
和 均为二氯甲烷,是同一种物质.
均为二氯甲烷,是同一种物质.
故互为同位素的是②,互为同素异形体的是⑤,互为同分异构体的是①,属于同一种物质的是③④⑦.
故答案为:②;⑤;①;③④⑦.
点评 本题考查了“四同”-同位素、同分异构体、同素异形体和同系物-概念的辨析,难度不大,应从概念来判断.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,其中S原子轨道的杂化类型是sp3,它是极性(填“极性”或“非极性”)分子.
,其中S原子轨道的杂化类型是sp3,它是极性(填“极性”或“非极性”)分子.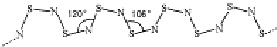
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质分子中均存在化学键 | |
| B. | 含有共价键的化合物不一定是共价化合物 | |
| C. | 阴阳离子间通过静电引力而形成的化学键叫做离子键 | |
| D. | 只有金属元素和非金属元素化合时才能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀盐酸滴在铜片上:Cu+2H+═Cu2++H2↑ | |
| B. | 氧化镁与稀盐酸混合:MgO+2H+═Mg2++H2O | |
| C. | 石灰石上滴加稀盐酸:CaCO3+2H+═Ca2++H2CO3 | |
| D. | 铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
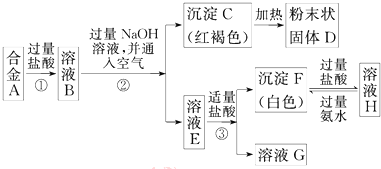
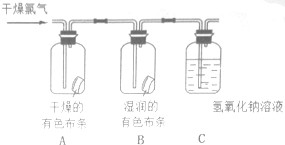 为了验证氯气的有关行政,某同学设计了如下的实验.
为了验证氯气的有关行政,某同学设计了如下的实验.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com