
| A. | ①②④③ | B. | ②④③① | C. | ②④① | D. | ②③④① |
科目:高中化学 来源: 题型:选择题
| A. | 铝片能和硫酸铜溶液反应 | |
| B. | 铝片能和氢氧化钠溶液反应 | |
| C. | 铝片不能和硝酸反应 | |
| D. | 铝片表面能形成具有保护作用的氧化膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
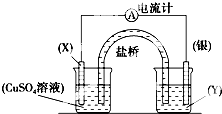 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 | 30% H2O2 | 15% H2O2 | 10% H2O2 | 5%H2O2 |
| 无催化剂、不加热 | 几乎不反应 | 几乎不反应 | 几乎不反应 | 几乎不反应 |
| 无催化剂、加热 | 360 | 480 | 540 | 720 |
| 有催化剂、不加热 | 10 | 25 | 60 | 120 |
| 实验操作 | MnO2状态 | 观察结果 | 反应所需时间 |
| 将MnO2加入5mL5%过氧化氢溶液中,不震荡 | 粉末状 | 剧烈反应,带火星的木条复燃 | 3.5分钟 |
| 块状 | 反应较慢,火星红亮但木条未复燃 | 30分钟 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溴水中有下列平衡Br2+H2O═HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 | |
| B. | 合成氨反应,N2(g)+3H2(g)═2NH3(g),△H<0,为提高氨的产率,理论上应采取降低温度的措施 | |
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,增大压强体系颜色变深 | |
| D. | SO2催化氧化成SO3的反应,往往需要使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
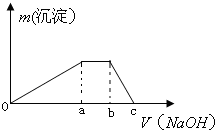 甲是一种盐,由A、B、C、D、E五种短周期元素元素组成.甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子.A元素原子核内质子数比E的少1,D、E处于同主族.用甲进行如下实验:
甲是一种盐,由A、B、C、D、E五种短周期元素元素组成.甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子.A元素原子核内质子数比E的少1,D、E处于同主族.用甲进行如下实验: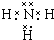
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 厨房中用的食盐、食醋都是电解质 | |
| B. | 石油的分馏、煤的干馏、石油的裂解都是化学变化 | |
| C. | 工业上通过电解熔融的氯化物制取Na、Mg、Al三种金属 | |
| D. | 石油裂化的主要目的是为了提高轻质油的质量和产量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com