
 CO(NH2)2(l)+H2O(g)在合成塔中进行。下图中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(l)+H2O(g)在合成塔中进行。下图中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。




 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源:不详 题型:填空题
 N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。
N2O4(g);△H<0。在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如下图所示。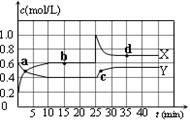
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 LCH3OH蒸汽与1 L水蒸汽反应生成1 L CO2气体与3 L氢气吸收热量49.0 kJ |
| B.1个CH3OH分子与1个水分子反应生成1个CO2分子与3个H2分子吸收49.0 kJ热量 |
| C.相同条件下1molCH3OH(g)与1mol H2O(g)的能量总和小于1molCO2(g)与3 mol H2(g)的能量总和 |
| D.1 molCH3OH蒸汽与1 mol液态水反应生成1mol CO2气体与3 mol 氢气吸收的热量小于49.0 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
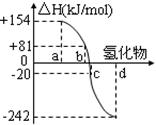
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 N2O4(g) △H=-52.7 kJ·mol-1
N2O4(g) △H=-52.7 kJ·mol-1 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0| 平衡时物质的量(mol) | n(NO) | n(H2O) |
| 温度T1 | 1.6 | 2.4 |
| 温度T2 | 1.2 | 1.8 |
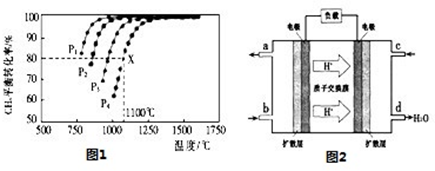
 =O2↑+2H2O,则阴极反应为 。有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由 。
=O2↑+2H2O,则阴极反应为 。有人提出,可以设计反应2CO=2C+O2(△H>0)来消除CO的污染。请你判断上述反应是否能自发进行并说明理由 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:| 物质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
 2CO(g)+2H2(g) 的△H= 。
2CO(g)+2H2(g) 的△H= 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):
2SO3(g)的混合体系中,SO3的百分含量和温度的关系如下图(曲线上任何一点都表示平衡状态):
 2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向左”、“向右”或“不”);
2SO3(g)的△H 0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将 移动(填“向左”、“向右”或“不”);
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2NH3(g) ΔH=-92.4 kJ·mol-1的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)
2NH3(g) ΔH=-92.4 kJ·mol-1的影响。实验结果如图所示:(图中T表示温度,n表示物质的量)
 2NO(g) ΔH=+180.5 kJ·mol-1
2NO(g) ΔH=+180.5 kJ·mol-1 2H2O(g) ΔH=-483.6 kJ·mol-1
2H2O(g) ΔH=-483.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.N4属于一种新型的化合物 | B.N4晶体熔点高,硬度大 |
| C.相同质量的N4能量高于N2 | D.1mol N4转变成N2将吸收882 kJ热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com