
【题目】根据方程式所表示的氧化还原反应设计一个原电池:Fe + H2SO4 = H2↑+ FeSO4
(1)装置采用烧杯和盐桥,画出此原电池的装置图______________
(2)指出原电池的正极材料和负极材料并标出电子的流向:正极材料_________,负极材料________ ,电子的流向_________
(3)写出两个电极上的电极反应并指出现象:负极反应 ___________ 、现象___________正极反应___________、现象_________________
(4)转移的电子数为2NA时,生成的H2在标准状况下的体积为________________
【答案】 Cu或C等 Fe 由Fe经外电路流向铜(或C) Fe -2e- = Fe2+ 铁极变细 2H+ +2e- = H2 产生无色无味的气体 22.4L
Cu或C等 Fe 由Fe经外电路流向铜(或C) Fe -2e- = Fe2+ 铁极变细 2H+ +2e- = H2 产生无色无味的气体 22.4L
【解析】
(1)根据电池反应式知,该反应中铁失电子发生氧化反应,作负极,因为有盐桥,正极可以是铜或碳等惰性电极,铁电极对应的溶液为可溶性的亚铁盐溶液,一般使用硫酸亚铁溶液,正极的电解液为硫酸,装置图为:

(2)负极为Fe,正极为Cu或C,负极: Fe- 2e- =Fe2+,正极:2H+ + 2e- =H2↑,外电路中,电子从铁流向铜(或C等惰性电极),
答案为:Cu或C等;Fe;由Fe经外电路流向铜(或C);
(3)负极失电子,发生氧化反应,负极反应: Fe- 2e- =Fe2+,实验现象为铁极变细;正极得电子发生还原反应,正极反应:2H+ + 2e- =H2↑,实验现象产生无色无味的气体,
答案为:Fe -2e- = Fe2+;铁极变细;2H+ 2e- = H2;产生无色无味的气体;
(4)根据电极反应2H+ + 2e- =H2↑,转移的电子数为2NA时,即转移2mol电子时,生成1mol氢气,则1mol气体在标况下的体积为22.4L,
答案为:22.4L;


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A. 0.1 mol·L1NaOH溶液:Na+、K+、![]() 、
、![]()
B. 0.1 mol·L1FeCl2溶液:K+、Mg2+、![]() 、
、![]()
C. 0.1 mol·L1K2CO3溶液:Na+、Ba2+、Cl、OH
D. 0.1 mol·L1H2SO4溶液:K+、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(g)![]() nB(g)+pC(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合右图中的两个图像,以下叙述正确的是
nB(g)+pC(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合右图中的两个图像,以下叙述正确的是
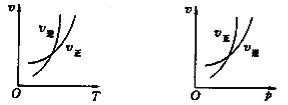
A. m>n,Q>0 B. m>n+p,Q>0 C. m<n+p,Q<0 D. m>n,Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 室温下用稀NaOH溶液吸收Cl2:Cl2+2OH![]() ClO+Cl+H2O
ClO+Cl+H2O
B. 用铝粉和NaOH溶液反应制取少量H2:Al+2OH![]()
![]() +H2↑
+H2↑
C. 室温下用稀HNO3溶解铜:Cu+2![]() +2H+
+2H+![]() Cu2++2NO2↑+H2O
Cu2++2NO2↑+H2O
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+![]() H2SiO3↓+2Na+
H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.常温下,稀释![]() 的氨水,溶液中
的氨水,溶液中![]() 、
、![]() 、
、![]() 均下降
均下降
B.![]() 的
的![]() 溶液:
溶液:![]()
C.常温下,![]() 相等的
相等的![]() 溶液中,溶质物质的量浓度大小关系是
溶液中,溶质物质的量浓度大小关系是![]()
D.当溶液中存在的离子只有![]() 、
、![]() 、
、![]() 、
、![]() 时,该溶液中离子浓度大小关系可能为
时,该溶液中离子浓度大小关系可能为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是合成一种功能高分子I的路线图。
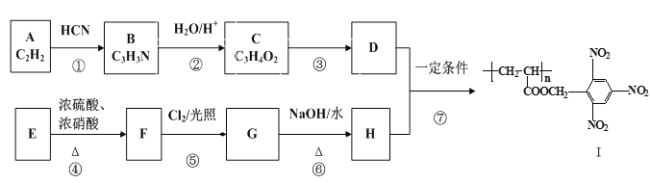 已知以下信息:
已知以下信息:
①RCN![]() RCOOH
RCOOH
②烃E的相对分子质量为92
回答下列问题:
(1)G中官能团的名称为__,__;
(2)反应①和⑥的反应类型分别为__,__;
(3)下列关于物质C的说法错误的是__(填字母标号)
A.可利用红外光谱法确定物质C中的官能团
B.物质C存在顺反异构体
C.物质C能与NaHCO3反应产生气体
D.物质C最多有8个原子共平面
(4)反应④的化学方程式为__;
(5)F的同分异构体中含有苯环且苯环上连有3个硝基的结构共有__种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下:2CH4(g)C2H4(g)+2H2(g) ΔH>0
化学键 | H—H | C—H | C=C | C—C |
E(kJ/mol) | a | b | c | d |
(1)已知相关化学键的键能如上表,甲烷制备乙烯反应的ΔH=____________ (用含a、b、c、d的代数式表示)。
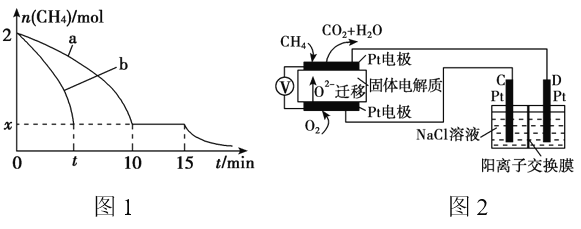
(2)T1温度时,向1 L的恒容反应器中充入2mol CH4 ,仅发生上述反应,反应过程中 0~15min CH4的物质的量随时间变化如图1,测得10~15min时H2的浓度为1.6mol/L。
①0~10min内CH4表示的反应速率为__________mol/(L·min)。
②若图1中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(CH4)变化曲线,其中表示催化剂表面积较大的曲线是 ________ (填“a”或 “b”)。
③15min时,若改变外界反应条件,导致n(CH4)发生图1中所示变化,则改变的条件可能是_____________________________________(任答一条即可)。
(3)实验测得v正=k正c2(CH4),v逆=k逆c(C2H4)·c2(H2)其中k正、k逆为速率常数仅与温度有关,T1温度时k正与k逆的比值为______ (填数值)。若将温度由T1升高到T2,则反应速率增大的倍数v正____v逆(填“>”“=”或“<”),判断的理由是_________________ 。
(4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了 Y2O3与 ZrO2的固体,可在高温下传导O2-。
①C极的Pt为______ 极(填“阳”或“阴” )。
②该电池工作时负极反应方程式为_____________________。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112mL,则阴极区所得溶液在25℃时pH=_______ (假设电解前后NaCl溶液的体积均为500mL)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘及其化合物在人类活动中占有重要地位。已知反应H2(g) + I2(g)![]() 2HI(g) ΔH=﹣11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:
2HI(g) ΔH=﹣11 kJ·mol-1。716K时,在一密闭容器中按物质的量比1:1充入H2(g)和I2(g),测得气体混合物中碘化氢的物质的量分数与反应时间的关系如下图:

(1)若反应开始时气体混合物的总压为p kPa,则反应在前20 min内的平均速率![]() (HI)=_____kPa·min-1(用含p的式子表示)。
(HI)=_____kPa·min-1(用含p的式子表示)。
(2)反应达平衡时,H2的转化率α(H2)=____________。
(3)上述反应中,正反应速率为v正= k正·c(H2)·c(I2),逆反应速率为v逆=k逆·c2(HI),其中k正、k逆为速率常数。升高温度,![]() ________(填“增大”“减小”或“不变”)。
________(填“增大”“减小”或“不变”)。
(4)降低温度,平衡可能逆向移动的原因是__________。
(5)1 mol H2(g)分子中化学键断裂时需要吸收436 kJ的能量,下图中的ΔH2=________kJmol-1
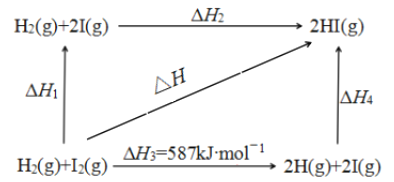
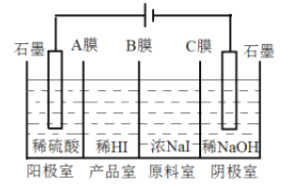
(6)氢碘酸可用“四室式电渗析法”制备,电解装置及起始的电解质溶液如上图所示。
①阳极电极反应式为______________。
②阳膜和阴膜分别只允许阳离子、阴离子通过,A膜为阳膜,则B膜为______膜,C膜为______膜。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸![]() 是一种精细磷化工产品,具有较强还原性,
是一种精细磷化工产品,具有较强还原性,![]() 可用电渗析法制备。“四室电渗析法”工作原理如图所示
可用电渗析法制备。“四室电渗析法”工作原理如图所示![]() 阳膜和阴膜分别只允许阳离子、阴离子通过
阳膜和阴膜分别只允许阳离子、阴离子通过![]() ,回答下列问题:
,回答下列问题:
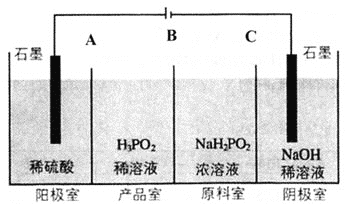
![]() 写出阳极的电极反应式:________。
写出阳极的电极反应式:________。
![]() 请判断离子交换膜类型:A________,B________。
请判断离子交换膜类型:A________,B________。![]() 填“阴膜”或“阳膜”
填“阴膜”或“阳膜”![]()
![]() 早期采用“三室电渗析法”制备
早期采用“三室电渗析法”制备![]() :将“四室电渗析法”中阳极室的稀硫酸用
:将“四室电渗析法”中阳极室的稀硫酸用![]() 稀溶液代替,并撤去阳极室与产品室之间的离子交换膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是________。
稀溶液代替,并撤去阳极室与产品室之间的离子交换膜,从而合并了阳极室与产品室。其缺点是产品中混有________杂质,该杂质产生的原因是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com