
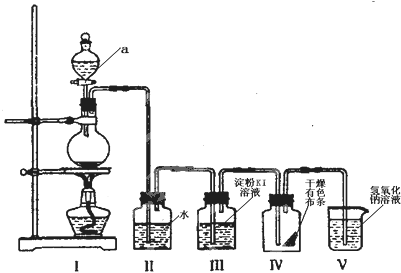
分析 (1)熟悉仪器的图型,说出其名称;
(2)浓盐酸具有挥发性,制取的氯气含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大;
(3)氯气具有强的氧化性,能够氧化碘离子生成单质碘;
(4)氯气与水反应生成次氯酸,次氯酸具有漂白性;
(5)氯气有毒,能够与氢氧化钠反应生成氯化钠、次氯酸钠和水,可以用氢氧化钠吸收.
解答 解:(1)分析装置图和仪器,装置A是氯气的发生装置,利用分液漏斗将浓盐酸滴入烧瓶中加热反应;
故答案为:分液漏斗;
(2)浓盐酸具有挥发性,制取的氯气含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,可以用饱和食盐水除去氯气中的氯化氢;
故答案为:吸收氯气中的氯化氢;
(3)氯气氧化碘离子为碘单质,离子方程式:Cl2+2I -=2Cl-+I2;
故答案为:Cl2+2I -=2Cl-+I2;
(4)氯气与水反应生成次氯酸,次氯酸具有漂白性,能够使有色布条褪色;
故答案为:能;
(5)氯气是污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收,反应的离子方程式:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查了氯气的制备和性质的检验,明确制备原理和氯气的性质是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钙溶液中通入过量二氧化碳 Ca2++2C1O+H2O+CO2=CaCO3↓+2HClO | |
| B. | 硫酸亚铁溶液中加入过氧化氢溶液 Fe2++2H2O2+4H+=Fe3++4H2O | |
| C. | 用氨水吸收少量二氧化硫 NH3•H2O+SO2=NH4++HSO3- | |
| D. | 硝酸铁溶液中加入过量氨水 Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制钛:用金属钠置换氯化钛(TiCl4)溶液中的钛 | |
| B. | 炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中的铁 | |
| C. | 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 | |
| D. | 炼铜:用黄铜矿(主要成分为CuFeS2)直接电解精炼得到纯度为99.9%的铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质 | B. | 弱酸盐 | C. | 强碱盐 | D. | 碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3,Na2CO3,HNO3 | B. | Na2CO3,AgNO3,HNO3 | ||
| C. | AgNO3,K2CO3,HNO3 | D. | AgNO3,Na2CO3,HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水土流失 | |
| B. | 汉江流域农业生产中长期使用农药 | |
| C. | 生活废水大量排入汉江,使水质富营养化 | |
| D. | 有毒的废水大量排入汉江 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com