
| A. | 元素的化学性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 元素的最外层电子数等于元素的最高化合价 | |
| C. | 原子序数越大,原子半径越大 | |
| D. | 元素周期律是元素原子核外电子排布周期性变化的结果 |
分析 A.元素的化学性质主要有价电子决定;
B.主族元素的最外层电子数等于最高化合价(O、F除外);
C.电子层数相同时,原子序数越大,原子半径越小;
D.随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化.
解答 解:A.元素的化学性质主要有价电子决定,所以元素的化学性质随着核外电子排布而呈周期性变化,故A错误;
B.主族元素的最外层电子数等于最高化合价(O、F除外),副族元素的化合价与最外层电子和次外层电子有关,故B错误;
C.电子层数相同时,原子序数越大,原子半径越小,同主族元素原子序数越大,原子半径越大,故C错误;
D.由原子的电子排布可知,随原子序数的递增,电子层数和最外层电子数都呈现周期性的变化而引起元素性质的周期性变化,即元素原子核外电子排布周期性变化是引起元素性质周期性变化的决定因素,故D正确;
故选D.
点评 本题考查了原子结构、元素周期律内容等知识,题目难度不大,明确原子结构与元素周期律的关系为解答关键,注意熟练掌握元素周期律内容、原子核外电子排布特点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
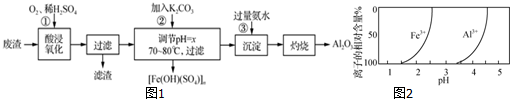
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
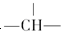 ,则该结构的烃的一氯取代物最多可能有几种(不考虑立体异构)( )
,则该结构的烃的一氯取代物最多可能有几种(不考虑立体异构)( )| A. | 9 | B. | 8 | C. | 7 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 600 | 700 |
| 平衡常数 | K1 | K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在由水电离产生的氢离子浓度为10-13 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3-四种离子能大量共存 | |
| B. | 已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-),且c(Mg2+)?c(CO32-)=6.82×10-6 | |
| C. | 对于反应2N2H4(l)=N2(g)+2H2(g),△H=-50.6 kJ?mol-1,它只在高温下自发进行 | |
| D. | 常温下,将0.2 mol?L-1某一元碱(ROH)溶液和0.1 mol?L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
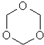 ),三聚甲醛可用作合成工程塑料等,还是日用化妆品冷烫精及脱毛剂的主要原料.下列有关三聚甲醛的说法中正确的是( )
),三聚甲醛可用作合成工程塑料等,还是日用化妆品冷烫精及脱毛剂的主要原料.下列有关三聚甲醛的说法中正确的是( )| A. | 三聚甲醛属于高分子化合物 | |
| B. | 三聚甲醛与甘油互为同分异构体 | |
| C. | 三分子甲醛合成三聚甲醛的反应属于加成反应 | |
| D. | 1 mol的三聚甲醛燃烧时生成CO2和H2O的物质的量一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、NO3-、CO32- | B. | Na+、CO32-、Cu2+、Cl- | ||
| C. | K+、Na+、Cl-、NH4+ | D. | K+、Cl-、Ba2+、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com