
| A.①②③④⑤⑥ | B.①②③④⑥ | C.①②③⑤ | D.②④⑥ |


科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
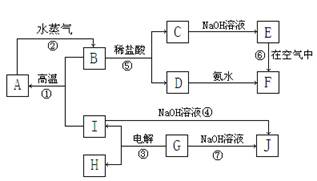
 填写下列空白:
填写下列空白:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子及其离子的核外电子层数等于该元素所在的周期数 |
| B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 |
| C.所含质子数和电子数都相同的粒子一定是分子 |
| D.同一元素的各种同位素的物理性质、化学性质均相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.BeO为两性氧化物 | B.Be(OH)2难溶于水 |
| C.H3BO3是难溶于水的弱酸 | D.B2O3既能溶于强酸又能溶于强碱 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com