
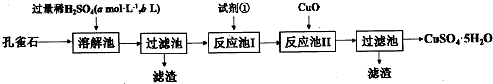
分析 孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe0、Si02,加入稀硫酸反应后生成二氧化碳气体,得到溶液硫酸铜溶液、硫酸亚铁液,为了提高反应速率,提高溶解率,可以将孔雀石要粉碎,过滤得到二氧化硅固体,滤液中加入氧化剂将Fe2+氧化成Fe3+,为了不引入新的杂质,最好用双氧水氧化,再加入CuO固体调节溶液pH沉淀铁离子过滤得到滤液为硫酸铜溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体,据此答题.
解答 解:孔雀石的主要成分为Cu2(OH)2CO3,还含少量Fe0、Si02,加入稀硫酸反应后生成二氧化碳气体,得到溶液硫酸铜溶液、硫酸亚铁液,为了提高反应速率,提高溶解率,可以将孔雀石要粉碎,过滤得到二氧化硅固体,滤液中加入氧化剂将Fe2+氧化成Fe3+,为了不引入新的杂质,最好用双氧水氧化,再加入CuO固体调节溶液pH沉淀铁离子过滤得到滤液为硫酸铜溶液,通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铜晶体,
(1)根据上面的分析可知,孔雀石首先要粉碎,其目的是加快溶解速率,提高溶解率,
故答案为:加快溶解速率,提高溶解率;
(2)从CuS04溶液中获取CuS04•5H20所进行的操作是加热、蒸发浓缩、冷却结晶、过滤,
故答案为:冷却结晶;
(3)根据上面的分析可知,溶解池中所发生的化学反应方程式为Cu2(OH)2C03+H2SO4=CuSO4+H2O+C02↑、FeO+H2SO4=FeSO4+H2O,
故答案为:Cu2(OH)2C03+H2SO4=CuSO4+H2O+C02↑、FeO+H2SO4=FeSO4+H2O;
(4)滤液中加入氧化剂将Fe2+氧化成Fe3+,为了不引入新的杂质,最好用双氧水氧化,故选D,反应池I中发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,
故答案为:D;2Fe2++2H++H2O2=2Fe3++2H2O;
(5)室温下,向反应池II中加入Cu0调pH为4,c(OH-)=10-10 mol/L,此时溶液中$\frac{c({Cu}^{2+})}{c({Fe}^{3+})}$=$\frac{\frac{Ksp[Cu(OH){\;}_{2}]}{{c}^{2}(OH{\;}^{-})}}{\frac{Ksp[Fe(OH){\;}_{3}]}{{c}^{3}(OH{\;}^{-})}}$=$\frac{\frac{2.2×1{0}^{-20}}{({1{0}^{-10})}^{2}}}{\frac{4.0×1{0}^{-38}}{(1{0}^{-10})^{3}}}$=5.5×107,
故答案为:5.5×107;
(6)含Cu2(OH)2C03质量分数为C%的孔雀石dg,则含铜元素的物质的量为$\frac{dC%}{222}$mol,所以理论上能获取CuS04•5H20的质量为$\frac{dC%}{222}$mol×250g/mol=$\frac{250dC%}{222}$g,
故答案为:$\frac{250dC%}{222}$g.
点评 本题考查学生对实验原理与实验操作的理解、物质分离提纯、元素化合物性质、氧化还原反应滴定、化学计算等,难度中等,清楚实验原理是解题的关键,需要学生具备扎实的基础知识与综合运用知识分析问题、解决问题的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3:2 | B. | 4:3 | C. | 4:1 | D. | 2:l |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L乙烯所含共用电子对数为5NA | |
| B. | 72g Ca02所含离子总数为3NA | |
| C. | 常温下,将1mol Cl2通入到过量的NaOH溶液中,电子转移数目为NA | |
| D. | 1L0.1mol/L Na2C03溶液中,C032-数目为0.lNA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/kJ•mol-1 | 197 | 360 | 499 | X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色溶液:CO32-NO3- Al3+ Ba2+ | |
| B. | 使酚酞变红的溶液:Na+ Cl- SO42-AlO2- | |
| C. | 加入Al能放出H2的溶液中 NH4+、Cl-、Na+、SO42- | |
| D. | 酸性溶液中:NO3-、SO32-、Na+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 资料卡 NO:2006-KI-001 主题:二氧化硫的还原性 ①课本上:向二氧化硫水溶液中滴加BaCl2溶液,再滴加0.5mL3%的过氧化氢溶液,振荡片刻后滴加稀盐酸,有白色沉淀生成 ②《无机化学》下册,P658:亚硫酸是较强的还原剂,可以将Cl2、I2、MnO4-还原为Cl-、I-、Mn2+,如: H2SO3+I2+H2O═H2SO4+2HI |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分别用炒锅加热两种样品,全部分解挥发,没有物质残留的是小苏打 | |
| B. | 先将两样品配成溶液,分别加入CaCl2,无白色沉淀生成的是小苏打 | |
| C. | 两只小玻璃杯,分别加入少量两种样品,再加入等浓度等体积的食醋,产生气泡快的是小苏打 | |
| D. | 先将两样品配成溶液,分别加入澄清石灰水,无白色沉淀生成的是小苏打 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com