
| A. | 镁的金属性比铝弱 | |
| B. | 镁和铝的氧化物都可以与盐酸反应 | |
| C. | 镁和铝的氧化物都可以与氢氧化钠溶液反应 | |
| D. | 镁和铝的工业制法都是通过电解他们对应的氧化物 |
分析 A.金属活动顺序表分析,镁在铝前面;
B.氧化镁是碱性氧化物,氧化铝是两性氧化物,都可以和盐酸反应生成盐和水;
C.氧化镁是碱性氧化物,氧化铝是两性氧化物,氧化铝和氢氧化钠溶液反应;
D.工业制备镁是电解熔融氯化镁,制备铝是电解熔融氧化铝;
解答 解:A.金属活动顺序表分析,镁在铝前面,金属活泼性镁比铝强,故A错误;
B.氧化镁是碱性氧化物,氧化铝是两性氧化物,都可以和盐酸反应生成盐和水,MgO+2HCl=MgCl2+H2O,Al2O3+6HCl=2AlCl3+3H2O,故B正确;
C.氧化镁是碱性氧化物,氧化铝是两性氧化物,氧化镁和氢氧化钠溶液不反应,氧化铝和氢氧化钠溶液反应Al2O3+2NaOH=2NaAlO2+H2O,故C错误;
D.工业制备镁是电解熔融氯化镁,制备铝是电解熔融氧化铝,氯化铝是共价化合物熔融状态不导电,故D错误;
故选B.
点评 本题考查了镁、铝及其化合物性质的分析判断,主要是氧化物性质的理解应用,题目难度中等.


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:选择题
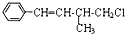
| A. | 该有机物的分子式为C11H13Cl | |
| B. | 该有机物能使溴水褪色 | |
| C. | 该有机物遇硝酸银溶液产生白色沉淀 | |
| D. | 该有机物在一定条件下,能发生消去反应或取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲可能是Pb304和PbO的混合物 | |
| B. | 整个反应过程中转移电子的总量为2.1mol | |
| C. | 若甲与浓盐酸充分反应,则需要消耗HCl的总量为2.8 mol | |
| D. | 甲中各物质的物质的量之比可能是n(PbO2):n(Pb304):n(PbO)=3:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
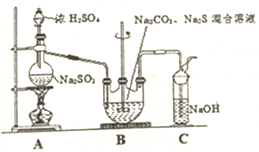 硫代硫酸钠晶体(Na2S203•5H20)俗名“大苏打”.己知它易溶于水,难溶于乙醇,加热和遇酸易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
硫代硫酸钠晶体(Na2S203•5H20)俗名“大苏打”.己知它易溶于水,难溶于乙醇,加热和遇酸易分解.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾和硫酸铁均可用作净水剂 | |
| B. | 有单质参加的化学反应一定是氧化还原反应 | |
| C. | 溶液因不带电而稳定,胶体因带电而不稳定 | |
| D. | 相同质量的铝粉,分别放入足量的盐酸和氢氧化钠溶液中,放出的氢气在同温同压下的体积之比是1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
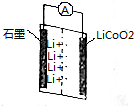 某锂离子二次电池装置如图所示,其放电时的总反应为Li1-xCoO2+LixC6═6C+LiCoO2.下列说法正确的是( )
某锂离子二次电池装置如图所示,其放电时的总反应为Li1-xCoO2+LixC6═6C+LiCoO2.下列说法正确的是( )| A. | 石墨为正极 | |
| B. | 充电时,阳极质量不变 | |
| C. | 充电时,阴极反应式为xLi-xe-═xLi+ | |
| D. | 放电时,正极反应为xLi+Li1-xCoO2+xe-═LiCoO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
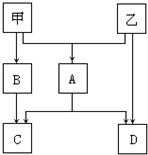 甲、乙是两种常见短周期元素的单质,其有关化合物的性质如图所示,其中C为白色沉淀,D为气体.
甲、乙是两种常见短周期元素的单质,其有关化合物的性质如图所示,其中C为白色沉淀,D为气体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
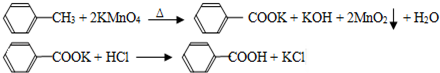
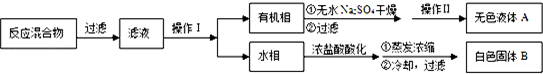
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶 解,冷却、过滤 | 得到白色晶体和无色溶液 | ----------------- |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,加热使其融化,测其熔点 | 熔点为122.4℃ | 白色晶体是苯甲酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com