
分析 本题以实验室制备磷酸铁为载体,探究铁在潮湿的空气里发生吸氧腐蚀得到氧化铁的原理、溶液里Fe3+和Fe2+的转化及检验、以及利用氧化还原反应原理进行滴定测定溶液里Fe2+的浓度,还考查了通过升温、搅拌等可以加快反应速率等理论,据此可作答;
(1)铁在潮湿的空气里很容易发生电化学腐蚀,主要是吸氧腐蚀,正极上氧气得电子被还原,铁锈的主要成份是氧化铁,用硫酸溶解生锈有铁屑时,氧化铁和硫酸反应生成硫酸铁,铁与硫酸铁反应生成硫酸亚铁,如果铁过量,溶液里应该没有
+3价铁;
(2)结合影响反应速率的影响因素可知温度越高,反应速率越快;
(3)①K2Cr2O7溶液具有强氧化性,应装在酸式滴定管中,注入前酸式滴定管要检漏、水洗,最后再用标准的K2Cr2O7溶液润湿;
②根据Fe2+和K2Cr2O7之间的关系式计算亚铁离子物质的量,再计算得到浓度;
③为使滤液中的Fe2+完全被H2O2氧化,加入的氧化剂要过量,且使反应物充分反应.
解答 解:(1)铁在潮湿的空气里发生吸氧腐蚀,正极电极反应式为O2+4e-+2H2O═4OH-,生成的铁锈主要成份是Fe2O3,将生锈的铁屑放入H2SO4溶液中充分溶解后,因过量的铁能将+3价的铁还原成+2价,因此反应后的溶液里不一定有Fe3+,发生反应的离子方程式为Fe+2Fe3+=3Fe2+,故答案为:O2+4e-+2H2O═4OH-;Fe2O3;Fe+2Fe3+=3Fe2+;
(2)温度越高,反应速率越快,所以反应加热的目的是加快铁与稀硫酸反应速率,故答案为:加快Fe和稀硫酸的反应速率;
(3)①向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、用蒸馏水洗,为防止滴定管附着的水稀释标准液,还需要用用标准液润洗2-3次,K2Cr2O7溶液具有强氧化性,能氧化橡胶管,需要盛放在酸式滴定管中,故答案为:用标准液润洗2-3次;酸式;
②若滴定v mL滤液中的Fe2+,消耗a mol•L-1 KMnO4标准溶液b mL,Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,
根据Fe2+和K2Cr2O7之间的关系式得c(Fe2+)=$\frac{amol/L×b×1{0}^{-3}L×6}{v×1{0}^{-3}L}$=$\frac{6ab}{x}$mol/L,故答案为:$\frac{6ab}{x}$;
③A、加入适当过量的H2O2溶液,导致铁离子能完全反应,故A正确;
B、缓慢滴加H2O2溶液并搅拌,反应物接触面积增大,能使铁离子完全反应,故B正确;
C、加热,使反应在较高温度下进行,虽然反应速率加快,但能促进亚铁离子水解而产生杂质,故C错误;
D、用氨水调节溶液pH=7,亚铁离子和氢氧根离子反应生成氢氧化亚铁杂质,故错误;
故答案为:A、B.
点评 本题以铁及其化合物为载体考查了物质的制备,涉及氧化还原反应、实验操作、反应速率的影响因素等知识点,根据物质之间的关系式、实验操作的规范性、影响反应速率的因素等知识点来分析解答,题目难度中等.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源:2017届广西桂林十八中高三上10月月考化学试卷(解析版) 题型:选择题
下列叙述不正确的是( )
A.钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火
B.探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的 反应速率偏高
反应速率偏高
C.蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置
D.为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管滴加蒸馏水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
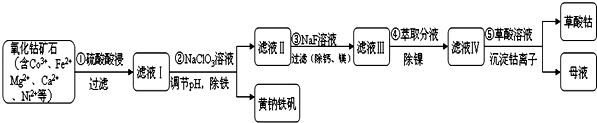
| 序号 | 矿石粒度/目 | 钴浸出率/% |
| 1 | -60 | 9.8 |
| 2 | -120 | 25.5 |
| 3 | -200 | 41.18 |
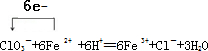 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、NO3-、SO42- | |
| B. | 0.1 mol•L-1Na2S溶液:SO42-、K+、Cl-、Cu2+ | |
| C. | 0.1 mol•L-1AgNO3 溶液:H+、K+、SO42-、Br- | |
| D. | 0.1 mol•L-1NaAlO2 溶液:OH-、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Zn和MnO2都是足量的,则前一反应中盐酸全部被还原,后一反应中盐酸部分被氧化 | |
| B. | 两个都是氧化还原反应 | |
| C. | 盐酸都是被还原 | |
| D. | 等物质的量的Zn和MnO2分别与足量的浓盐酸反应,转移的电子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com