
【题目】关于下列各图的叙述,正确的是( )
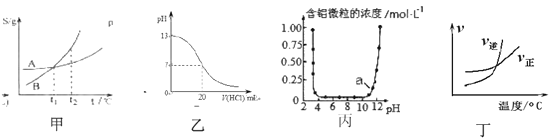
A. 根据图甲(S表示溶解度)表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数A=B
B. 图乙表示25℃时,用0.1mol ·L-1盐酸滴定20mL 0.1mol ·L-1NaOH溶液的pH随加入酸体积的变化
C. 根据图丙表示Al3+与OH-反应时含铝微粒浓度变化曲线,图中a点溶液中大量存在Al3+
D. 根据图丁可判断可逆反应“A2(g)+3B2(g)![]() 2AB3(g)”的ΔH>0
2AB3(g)”的ΔH>0
【答案】A
【解析】
A.将A、B饱和溶液分别由t1℃升温至t2℃时两溶液中溶质和溶剂的量都不会改变, 二者t1℃溶解度相同即浓度相同,所以t2℃时溶质的质量分数相等,故A正确;
B.0.1molL-1NaOH溶液的pH为13,用0.1molL-1盐酸滴定恰好中和时pH为7,因浓度相同,则体积相同,但酸碱中和在接近终点时,pH会发生突变,曲线的斜率会很大,故B错误;
C.a点所示pH接近12,碱性环境中主要以偏铝酸根离子形式存在,a点溶液中不会大量存在Al3+,故C错误;
D.图丁说明升高温度逆反应速率大于正反应速率,平衡向逆反应方向移动,即正反应是放热反应,△H<0,故D错误;
答案:A


 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】常温下,NH3·H2O的电离平衡常数Kb=1.8×10-5,则常温下0.02mol/L的NH4Cl的PH值为( )(lg3=0.48)
A. 4.52B. 5.48C. 3.48D. 8.52
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有等物质的量的NaHCO3和KHCO3的混合物ag与100mL盐酸反应,题中设计的气体体积均以标准状况计,填空时可以用带字母的公式表示。
(1)该混合物中NaHCO3和KHCO3的质量比为:____。
(2)如碳酸氢盐与盐酸恰好完全反应则盐酸的浓度为:____。
(3)如盐酸过量,生成CO2的体积为:____。
(4)如果反应后碳酸氢盐有剩余,盐酸不足量要计算生成的CO2的体积,还需知道:____。
(5)若NaHCO3和KHCO3不是以等物质的量混合,则ag固体混合物与足量的盐酸完全反应时生成CO2的体积范围是:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】平板电视显示屏生产过程中产生大量的废玻璃(含SiO2、Fe2O3、CeO2、FeO等物质)。某小组以此废玻璃为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4。
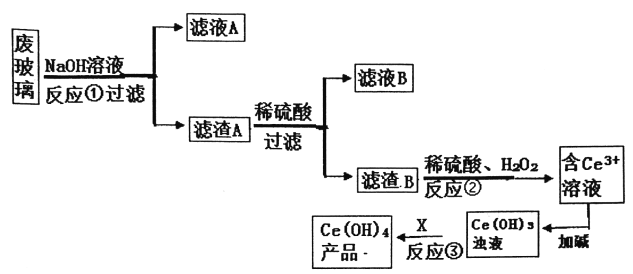
己知:CeO2不溶于强酸或强碱;Ce3+易水解,酸性条件下,Ce4+有强氧化性。
(1)废玻璃在NaOH溶液浸洗前往往要进行的操作________,反应①的离子方程式_______。
(2)反应②的离子方程武是____________。
(3)为了得到较纯的Ce3+溶液,反应②之前要进行的操作是______。
(4)反应③需要加入的试剂X可以是_________。
(5)用滴定法测定制得的Ce(OH)4产品纯度。
![]()
用FeSO4溶液滴定用_____做指示剂,滴定终点的现象_______若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数____(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷和镍均为重要的无机材料,在化工领域具有广泛的应用。
(1)基态As原子的价层电子的电子云轮廓图形状为_____________。与砷同周期的主族元素的基态原子中,第一电离能最大的为_____________(填元素符号。)
(2)Na3AsO3可用于碘的微量分析。
①Na+的焰色反应呈黄色,金属元素能产生焰色反应的微观原因为__________________________。
②Na3AsO3中所含阴离子的立体构型为_____________,写出一种与其互为等电子体的分子:_____________(填化学式)。
(3)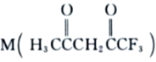 可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含
可用于合成Ni2+的配体,M中C原子的杂化方式为___________,其所含![]() 键和π键的数目之比为___________。
键和π键的数目之比为___________。
(4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为___________。区分晶体Ni和非晶体Ni的最可靠的科学方法为___________。
(5)某砷镍合金的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,则该晶体的密度ρ=___________g·cm-3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缓释布洛芬是常用的解热镇痛药物,其一种合成路线如下:

已知:① 
② R1COOR2 + R3OH ![]() R1COOR3 + R2OH
R1COOR3 + R2OH
(1)按照官能团分类,A所属的类别是______。
(2)反应①的化学方程式是______。
(3)试剂X的结构简式是______。
(4)F→G的反应类型是______。
(5)H的结构简式是______。
(6)反应②的化学方程式是______。
(7)缓释布洛芬能缓慢水解释放出布洛芬,请将下列方程式补充完整。
 + 2n H2O
+ 2n H2O![]() ______
______
(8)以丙烯为起始原料制备丙酮酸甲酯(![]() )的合成路线如下,请补充完整(无机试剂任选)。_____
)的合成路线如下,请补充完整(无机试剂任选)。_____
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某未知溶液可能含有Cl-、SO42-、CO32-、Mg2+、Al3+和K+。取100mL该溶液进行实验,过程记录如下。由此可知原溶液中
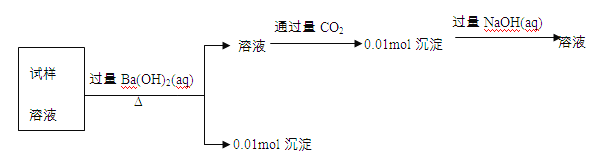
A.一定有Cl- B.一定有CO32- C.一定没有K+ D.一定没有Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于3 区域的( )

A.Cl2+2KBr = Br2+2KCl
B.2NaHCO3 ![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
C.4Fe(OH)2+O2+2H2O =4Fe(OH)3
D.2Na2O2+2H2O =4NaOH+ O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了清理路面积雪,人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54mol电子。
(1)该融雪剂的化学式是____,该物质中化学键类型是______,电子式是______。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是__________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子均达到了8e-稳定结构,该分子的结构式为_________,电子式为_______,化学键类型为_________(填“离子键”“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成____,其化学键类型为___;加热时生成_____,其化学键类型为_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com